- Автор: Super User
- Категорія: №1 (08) 2018
- Опубліковано: 29 серпня 2018
- Перегляди: 5279
УДК 616.379–008.64:617.735
https://doi.org/10.30702/Ophthalmology.2018/08.02
Семенко В. В.1, Сердюк В. Н.1, 2, Савицкий И. В.3
1КУ «Днепропетровская областная клиническая офтальмологическая больница», г. Днепр, Украина
2Днепропетровская медицинская академия МОЗ Украины, г. Днепр, Украина
3Одесский национальный медицинский университет, г. Одесса, Украина
Резюме. Моделирование сахарного диабета (СД) 1-го типа является основой разработки новых методов лечения диабетической ретинопатии. Цель работы – исследование активности сукцинатдегидрогеназы (СДГ), лактатдегидрогеназы (ЛДГ) и малатдегидрогеназы (МДГ) для оценки состояния энергетического обмена в тканях глазного яблока на фоне разработанной модели СД 1-го типа. Диабет моделировали трехкратным внутрибрюшинным, с интервалом 5 дней, введением аллоксана в дозе 7,5 мл/200 г массы животного. Введение аллоксана осуществляли на фоне свободного доступа животных к 5 % раствору фруктозы. В ганглионарном слое по классу умеренной активности ферментов выявлены различия в удельном весе животных при анализе активности ЛДГ, по классам высокой и очень высокой активности ферментов выявлены различия в удельном весе животных при анализе активности МДГ, ЛДГ и СДГ. В гранулярном слое обнаружены различия между группой с моделью СД 1-го типа и контрольной группой в удельном весе животных при анализе активности СДГ и ЛДГ. В сосудистом слое по классу высокой и умеренной активности ферментов обнаружены различия удельного веса животных при анализе активности СДГ и ЛДГ, а по классу очень высокой ферментативной активности при анализе активности МДГ и ЛДГ. В результате исследования был показан глюкозотоксический эффект экспериментальной модели СД 1-го типа и выявлены изменения активности ферментов цикла Кребса в глазном яблоке. Полученные результаты свидетельствуют о том, что уже на ранних сроках развития СД 1-го типа происходят значительные изменения в процессах биоэнергетики митохондрий, что указывает на необходимость включения в комплексное лечение СД 1-го типа в дебюте заболевания препаратов метаболического профиля в виде субстратов цикла трикарбоновых кислот для смягчения патогенного влияния глюкозотоксичности на ткани глаза.
Ключевые слова: сахарный диабет, аллоксановая модель, диабетическая ретинопатия, окислительно-восстановительные ферменты.
ВВЕДЕНИЕ
Сахарный диабет (СД) является одной из основных причин слепоты вследствие развития и прогрессирования диабетической ретинопатии (ДР). Количество пациентов, страдающих СД и потерявших зрение, находится в пределах от 26 % при СД 2-го типа и до 84 % при СД 1-го типа. ДР выявляется у 50 % от общего числа больных с СД 1-го типа со стажем болезни более 10 лет и у 75–90 % больных со стажем диабета более 15 лет [1]. Важным аспектом изучения влияния СД на развитие ДР является экспериментальное моделирование. Согласно литературным данным, при развитии экспериментального диабета в различных тканях организма выявлено нарушение обмена и функции никотинамидных коферментов [2, 3, 4]. В то же время известно, что внутренняя мембрана митохондрий – комплексный и чувствительный объект исследования для оценки токсического эффекта острой и хронической гипергликемии (глюкозотоксичности). Для его оценки важным представляется исследование активности митохондриальных НАД-зависимых дегидрогеназ, которые также являются ферментами тканевого дыхания – сукцинатдегидрогеназы (СДГ), лактатдегидрогеназы (ЛДГ) и малатдегидрогеназы (МДГ) [5].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Исследование активности ферментов цикла Кребса в клетках ганглионарного, гранулярного слоя и в сосудистой оболочке глазного яблока для оценки глюкотоксического эффекта экспериментальной модели СД 1-го типа и состояния энергетического обмена.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводилось на 50 белых крысах линии Вистар аутобредного разведения, с массой тела 180–200 г. Лабораторные животные были разделены на 2 группы: 1-я группа контрольная – 20 интактных крыс, 2-я группа – 30 животных, у которых моделировали СД 3-кратным внутрибрюшинным, с интервалом 5 дней, введением аллоксана в дозе 7,5 мл/200 г массы животного. Введение аллоксана осуществляли на фоне свободного доступа животных к 5 % раствору фруктозы. Продолжительность эксперимента составила 30 суток. Исследуемых животных выводили из опыта декапитацией под легким эфирным наркозом. У крыс забирали 5 мл крови, в сыворотке которой ферментативным (глюкозооксидазным) методом определяли концентрацию глюкозы с использованием биохимического полуавтоматического анализатора Микролаб-300 (Нидерланды). Производили энуклеацию. Глазное яблоко замораживали жидким азотом при температуре –196 °С, а из полученных блоков изготовляли криостатные срезы толщиной 11 мкм, на которых определяли активность ферментов цикла Кребса (СДГ, МДГ, ЛДГ) по методике Лойда З. Ее основой является использование унифицированного раствора, к которому добавляются растворы соответствующего субстрата и кофермента [6]. СДГ, ЛДГ и МДГ являются кофермент-независимыми дегидрогеназами, не требующими для проявления своей активности присутствия никотинамидадениндинуклеотида (NAD+) или никотинамидадениндинуклеотидфосфата (NADР+). Метод выявления – с солями тетразоля. Применяли универсальный основной раствор для водных инкубационных сред. Основной раствор сукцината: 1 М ди-Nа-сукцинат-6 Н2О (270 мг/1 мл дистиллированной воды, устанавливали рН 7,2–7,4). Основной раствор субстрата для определения ЛДГ: 1 М DL-лактат натрия (112 мг/1 мл; устанавливали рН 7,2–7,4). Основной раствор субстрата для определения МДГ: 1 М L-малат натрия (187 мг/1 мл; устанавливали рН 7,2–7,4). Активность каждого исследуемого фермента определяли тетразолиевым методом [6]. Активность СДГ, МДГ и ЛДГ оценивали по 7-бальной полуколичественной шкале [7], на основе данных цитоспектрофотометрии и визуального описания гистоэнзимологических препаратов с помощью микроскопа Кarl Zeiss Primo Star (Германия). Критерии балльной оценки приведены в таблице 1.
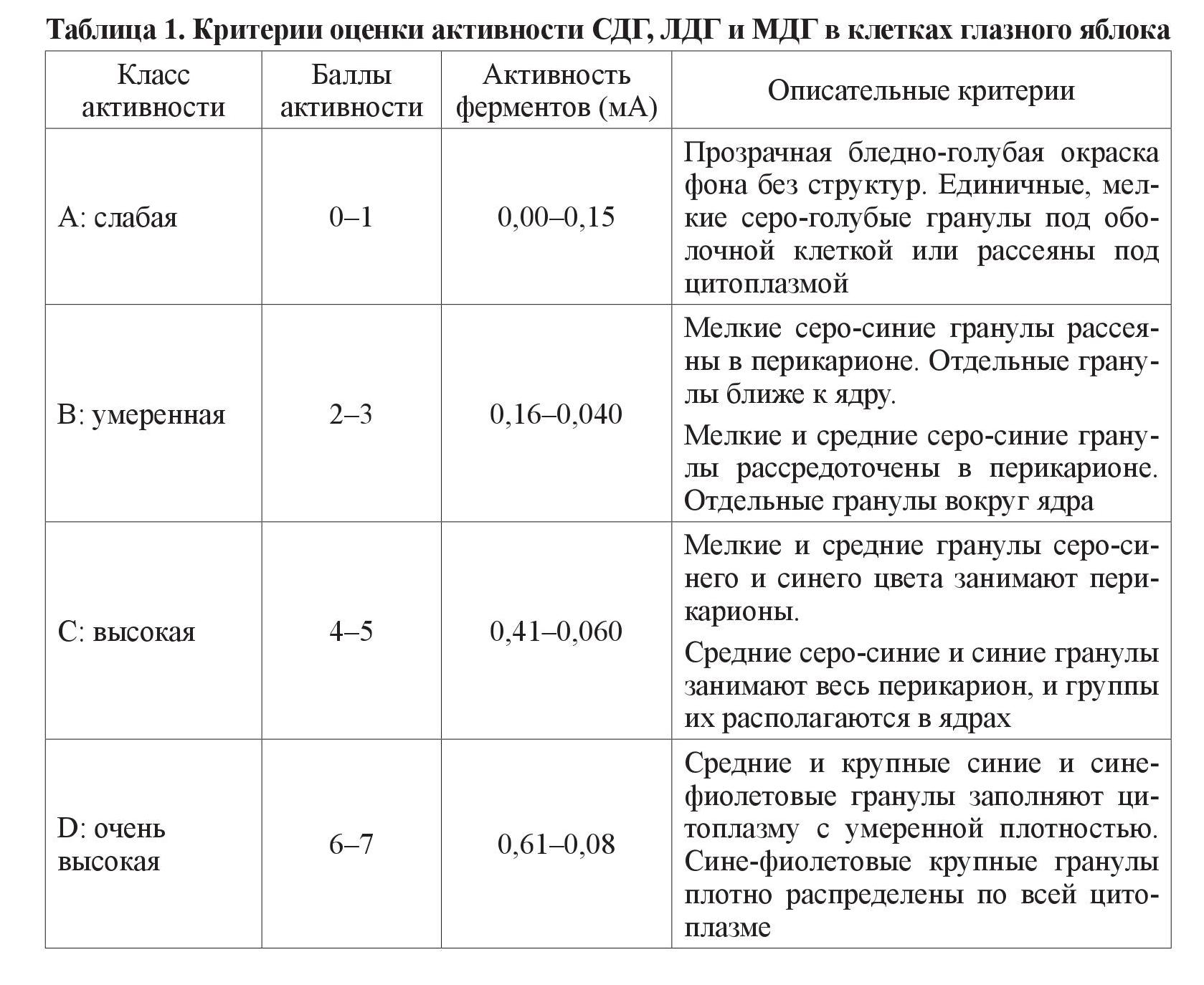
Исходные числовые ряды данных, выраженные количественно, проверялись на нормальность статистического распределения с помощью критерия Шапиро– Уилка (Shapiro–Wilks test) в пакете статистического анализа SPSS 19.0 [8]. Поскольку нас интересовали различия в распределении удельного веса животных по классам активности (слабом, умеренном, высоком, очень высоком) окислительно-восстановительных ферментов (СДГ, МДГ, ЛДГ) в различных оболочках глазного яблока (ганглионарной, гранулярной, сосудистой), мы использовали формулу ван дер Вардена для определения критерия t [9]. Вычисления проводили в табличном процессоре Excel 2016, сопоставляя эмпирическое значение критерия с критическими значениями с двусторонней критической областью на уровнях значимости p < 0,05, p < 0,01, p < 0,001, соответственно, полагая такие различия значимыми, высокозначимыми и очень высокозначимыми. Описательные статистики, представляемые в таблицах результатов, содержали доли признаков и стандартные ошибки в процентном выражении, что позволило сопоставлять доли подопытных животных из контрольной и экспериментальной групп по классам активности исследуемых ферментов.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Результаты биохимического исследования уровня гликемии у животных опытной группы показали, что концентрация глюкозы в крови у животных с СД к концу срока наблюдения составила 8,07 ± 0,33 ммоль/л, что достоверно выше, чем в контрольной (5,11 ± 0,22 ммоль/л) (р < 0,001). Летальных случаев не наблюдали.
Ниже приведены результаты оценки активности окислительно-восстановительных ферментов в слоях оболочки глазного яблока.
1. Ганглионарный слой (таблица 2).
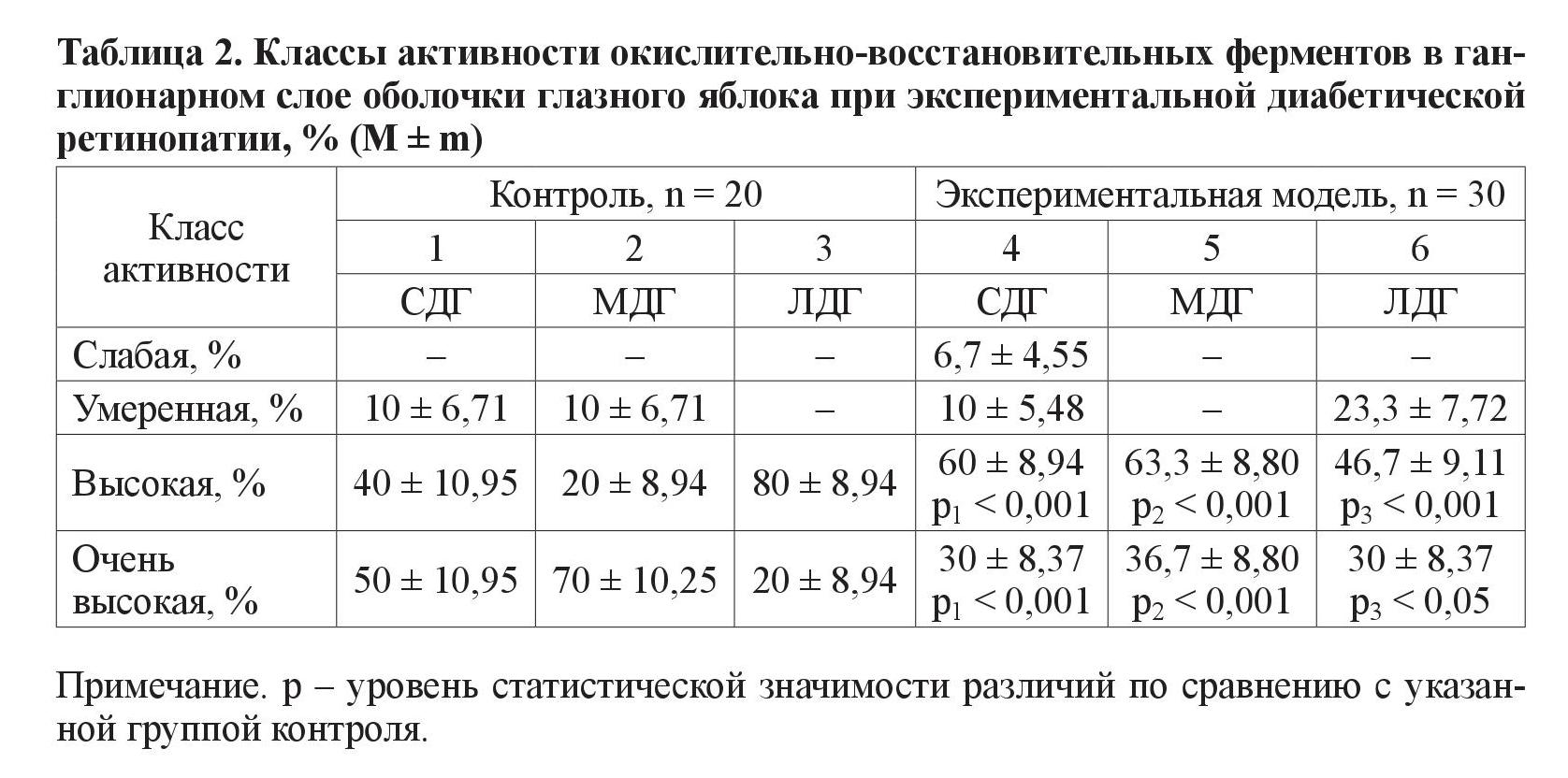
При исследовании класса умеренной активности выявлено очень высокозначимые различия (р < 0,001) между группами по ферменту ЛДГ. В экспериментальной группе у большего количества животных данный фермент находился в умеренном классе активности. Касательно класса высокой активности ферментов было выявлено очень высокозначимые различия (р < 0,001) между количеством крыс группы эксперимента и контрольной группы, у которых активность всех трех ферментов (СДГ, ЛДГ и МДГ) находилась в пределах данного класса. При этом обнаружено, что в экспериментальной группе большее количество животных, у которых МДГ и СДГ имели класс высокой активности, а в контрольной группе большее количество животных, у которых уже ЛДГ находился в пределах данного класса. При анализе класса очень высокой активности были получены следующие результаты: очень высокозначимые различия по числу особей при анализе ферментов СДГ, а в эксперименте их меньшее количество, чем в группе контроля. При анализе фермента МДГ наблюдается сходная картина. В то же время в экспериментальной группе у большего количества животных, чем в контрольной группе активность ЛДГ находится в пределах данного класса активности.
2. Гранулярный слой (таблица 3).
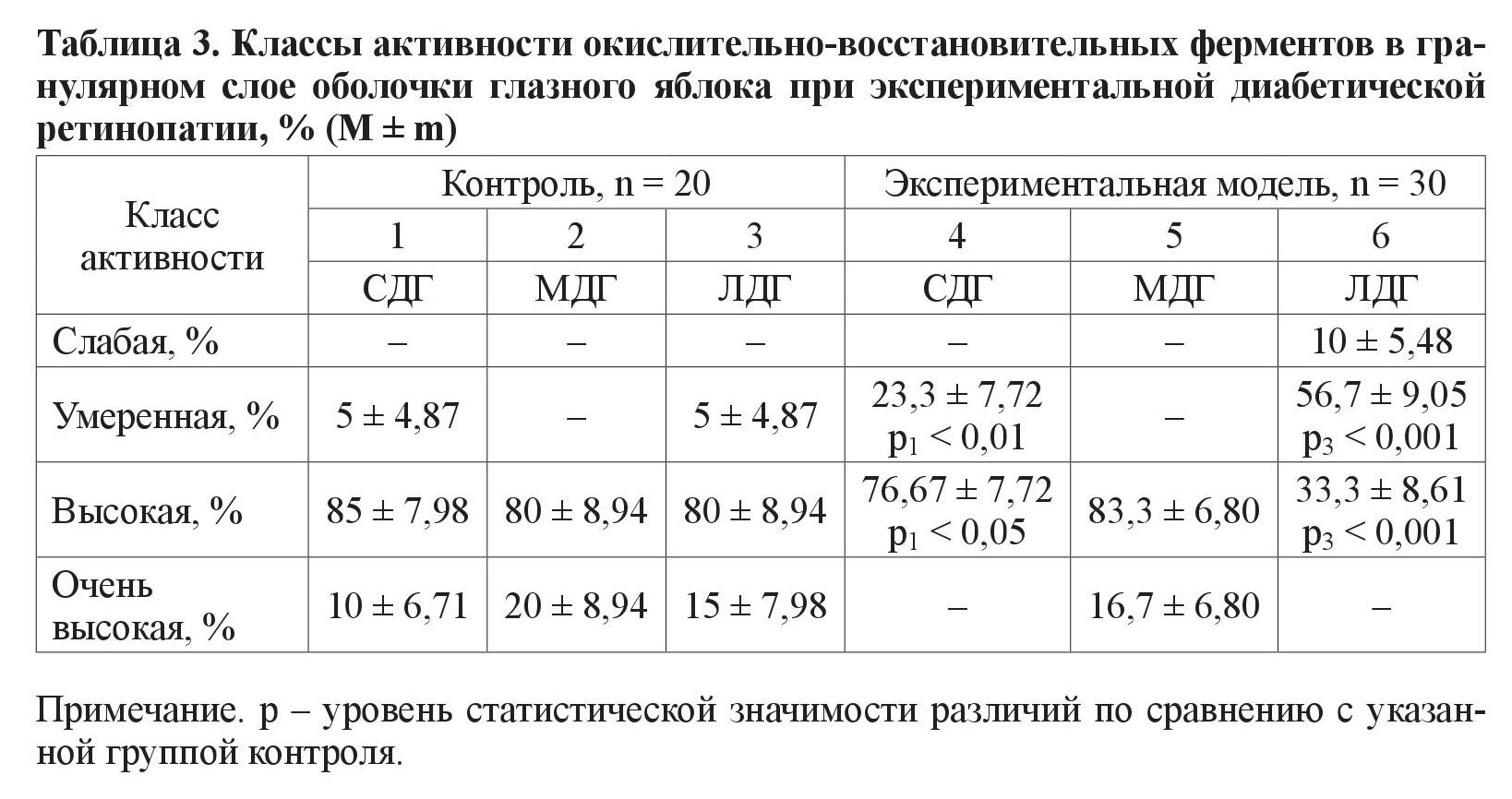
Обнаружено высокозначимое различие (р < 0,01) между количеством крыс исследуемых групп, у которых фермент СДГ находился в умеренном классе активности. Также в экспериментальной группе животных в этом классе преобладала активность фермента МДГ (результаты очень высокозначимы на уровне значимости р < 0,001). При анализе класса высокой ферментативной активности обнаружено, что в контрольной группе (по сравнению с крысами с моделью СД) преобладают животные с вышеуказанной активностью фермента СДГ (различия значимы на уровне р < 0,05). При анализе фермента МДГ наблюдается схожая картина, но с более высокозначимыми различиями (р < 0,001)
3. Сосудистый слой (таблица 4).
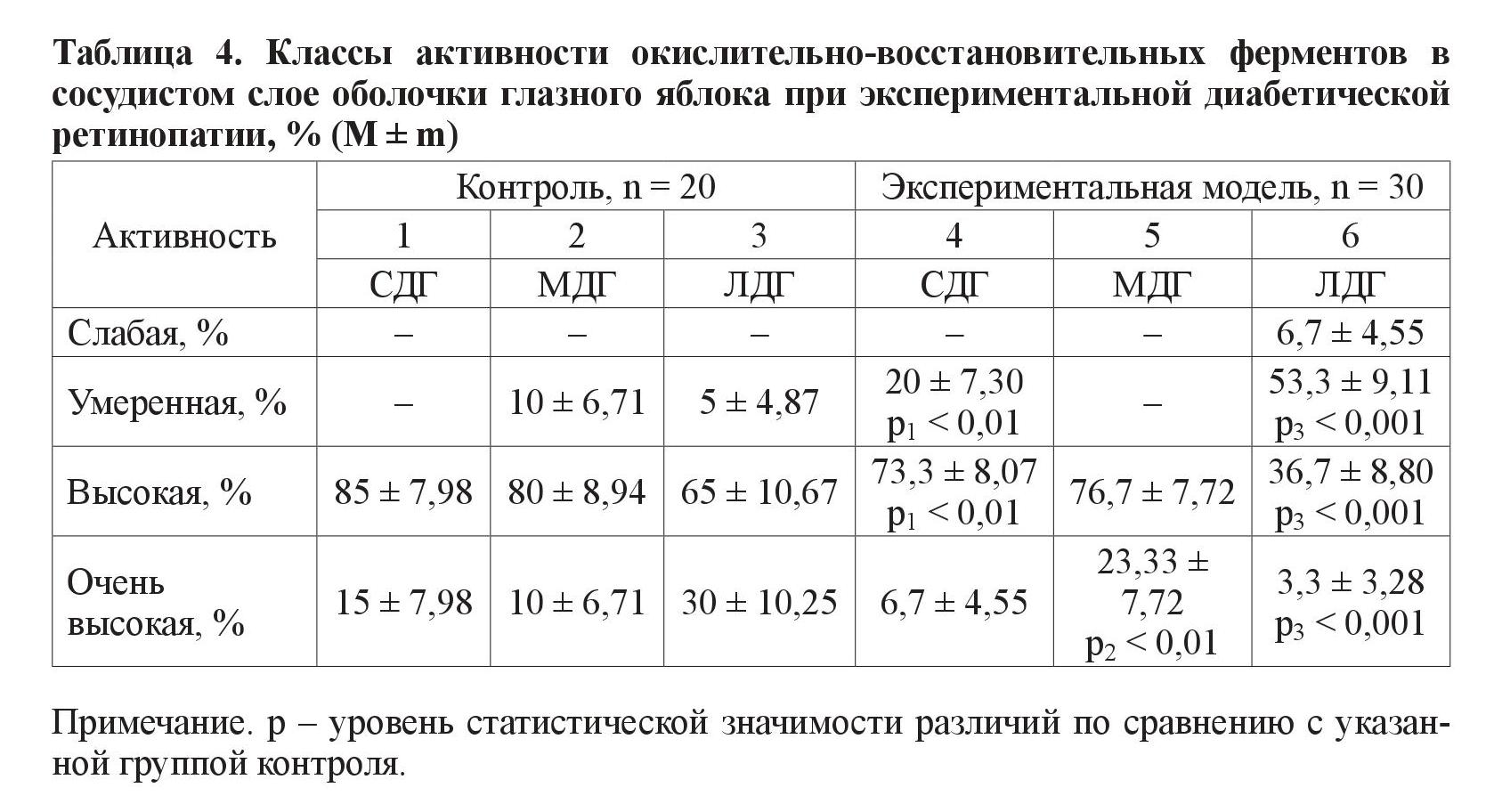
Для класса умеренной активности характерно преобладание животных экспериментальной группы при анализе фермента СДГ (р < 0,01) и МДГ (р < 0,001). Также при исследовании глазного яблока экспериментальных животных СДГ (р < 0,01) и МДГ (р < 0,001) отличается от нормы в классе высокой ферментативной активности, но в сторону меньшего, чем в контрольной группе, количества животных. Для класса очень высокой активности у животных с моделью СД в этом слое характерно преобладание МДГ (р < 0,01) и меньшее по количеству (в сравнении с контролем) проявление активности ЛДГ (р < 0,001).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Адаптация животных к аллоксановой модели СД представляет собой сложный патофизиологический процесс. При экспериментальном СД активность ферментов цикла Кребса на клеточном уровне обеспечивает изменение метаболизма, обусловленного глюконеогенезом в печени крыс [10]. Ресинтез гликогена является также ключевым процессом для адаптивной реакции организма к экстремальным условиям. Важную роль играет и энергетический обмен, связанный, главным образом, с функционированием цикла трикарбоновых кислот. Следовательно, динамика клеточного метаболизма обеспечивается путем изменения соотношения интенсивности окисления (распада) и ресинтеза глюкозы. Несмотря на большое количество исследований по изучению ферментативной активности, обуславливающей скорость энергетического и синтетического процессов, их роль еще недостаточно изучена [11, 12].
По результатам нашей работы, уровень глюкозы у животных с моделью СД 1-го типа оказался статистически значимо выше (в 1,58 раза) по сравнению с данными контрольной группы. Это свидетельствует о наличии у них стабильной гипергликемии, которая характерна для СД. Данный факт позволяет предположить, что предлагаемая модель СД адекватна основным патогенетическим механизмам этой патологии – дефициту инсулина. Следовательно, данные об изменении активности СДГ, ЛДГ и МДГ отражают суть изменений при диабетических ретинопатиях.
В ганглионарном слое глазного яблока в классе умеренной активности выявлены различия по количеству животных при анализе одного фермента – ЛДГ. По классам высокой и очень высокой активности выявлены различия при анализе всех трех исследуемых ферментов – МДГ, ЛДГ и СДГ. В гранулярном слое обнаружены достоверные различия между группой с моделью СД и контрольной, по количеству животных с умеренной и высокой активностью СДГ и ЛДГ. В сосудистом слое статистически выявлены различия между группами животных, в которых ферменты СДГ и ЛДГ находились в классах высокой и умеренной активности. Количество животных эксперимента и контроля с очень высокой ферментативной активностью достоверно различается при анализе МДГ и ЛДГ.
Полученные результаты объясняются взаимодействием активности ферментов на различных этапах цикла Кребса, при которых наблюдается перестройка окислительно-восстановительных процессов. Это возможно при обратной активации части цикла трикарбоновых кислот [13, 14].
Наблюдающиеся изменения соотношений активности СДГ, ЛДГ и МДГ свидетельствуют о возможном образовании малата напрямую из дополнительных источников (α-кетоглутарат, пируват), за счет чего компенсаторно активируется дикарбоновая часть цикла Кребса, что наблюдается при субстрат-кислородном дефиците, характерном для СД [13–15].
Одновременно наблюдается тенденция к преобладанию количества животных с более высокой активностью ЛДГ у интактных крыс по сравнению с экспериментальной группой. Поскольку гистохимически выявляется активность двух изоферментов ЛДГ (ЛДГ2 и ЛДГ3), то можно сказать, что нарушение транспорта глюкозы приводит к угнетению реакции преобразования лактата в пируват, что способствует развитию метаболического ацидоза и изменению структуры и функций тканей [12, 16].
Таким образом, на основе модифицированной нами модели СД 1-го типа получены данные, свидетельствующие о том, что уже на ранних сроках развития СД 1-го типа происходят значительные изменения в процессах биоэнергетики митохондрий, что указывает на необходимость включения в комплексное лечение СД 1-го типа в дебюте заболевания препаратов метаболического профиля в виде субстратов цикла трикарбоновых кислот для смягчения патогенного влияния глюкозотоксичности на ткани глаза.
ВЫВОДЫ
1. В клетках ганглионарного и гранулярного слоев, а также в сосудистой оболочке глаза активность ферментов цикла Кребса в группе экспериментальных животных существенно отличается от таковой в контрольной группе.
2. В ганглионарном слое по классам слабой и умеренной активности ферментов выявлено появление экспериментальных животных при анализе активности СДГ и ЛДГ; по классу высокой активности – увеличение удельного веса экспериментальной группы животных по показателям СДГ и МДГ, и наоборот, уменьшение их удельного веса по показателю ЛДГ, по классу очень высокой активности – уменьшение их удельного веса по показателю активности СДГ и МДГ и увеличение – по активности ЛДГ.
3. В гранулярном слое по классу слабой активности выявлено появление экспериментальных животных при анализе активности ЛДГ, по классу умеренной активности – увеличение удельного веса животных по активности СДГ и ЛДГ, по классу высокой активности – уменьшение удельного веса животных по активности СДГ и ЛДГ по сравнению с контрольной группой.
4. В сосудистом слое по классу слабой активности выявлено появление экспериментальных животных при анализе активности ЛДГ, по классу умеренной активности ферментов – увеличение удельного веса экспериментальных животных по анализу активности СДГ и ЛДГ; по классу высокой активности ферментов – снижение удельного веса животных экспериментальной группы по активности СДГ и ЛДГ, по классу очень высокой активности удельный вес животных экспериментальной группы больше по показателю МДГ и меньше по показателю активности ЛДГ.
5. Таким образом, в результате экспериментального моделирования СД 1-го типа показано ее глюкозотоксическое влияние на активность ферментов цикла Кребса в оболочках глазного яблока в виде появления субстрат-кислородного дефицита и метаболического ацидоза.
Семенко В. В.1, Сердюк В. М.1, 2, Савицький І. В.3
1КЗ «Дніпропетровська обласна клінічна офтальмологічна лікарня», м. Дніпро, Україна
2Дніпропетровська медична академія МОЗ України, м. Дніпро, Україна
3Одеський національний медичний університет, м. Одеса, Україна
Дослідження активності ферментів циклу кребса в тканинах очного яблука при експериментальній діабетичній ретинопатії
Резюме. Моделювання цукрового діабету (ЦД) 1-го типу є основою розробки нових методів лікування діабетичної ретинопатії.
Мета роботи – дослідження активності сукцинатдегідрогенази (СДГ), лактатдегідрогенази (ЛДГ) і малатдегідрогенази (МДГ) для оцінювання стану енергетичного обміну в тканинах очного яблука на тлі розробленої моделі ЦД 1-го типу. Діабет моделювали триразовим внутрішньочеревним, з інтервалом 5 днів, уведенням алоксану в дозі 7,5 мл/200 г маси тварини. Уведення алоксану здійснювали на тлі вільного доступу тварин до 5 % розчину фруктози. У гангліонарному шарі за класом помірної активності ферментів виявлені відмінності в питомій вазі тварин при аналізі активності ЛДГ, за класами високої та дуже високої активності ферментів виявлені відмінності в питомій вазі тварин при аналізі активності МДГ, ЛДГ і СДГ. У гранулярному шарі виявлені відмінності між групою з моделлю ЦД 1-го типу та контрольною групою в питомій вазі тварин при аналізі активності СДГ і ЛДГ. У судинному шарі за класом високої та помірної активності ферментів виявлені відмінності питомої ваги тварин при аналізі активності СДГ і ЛДГ, а за класом дуже високої ферментативної активності при аналізі активності МДГ і ЛДГ. Отримані результати свідчать, що вже на ранніх термінах розвитку ЦД 1-го типу відбуваються значні зміни в процесах біоенергетики мітохондрій, що вказує на необхідність включення в комплексне лікування ЦД 1-го типу в дебюті захворювання препаратів метаболічного профілю у вигляді субстратів циклу трикарбонових кислот для пом'якшення патогенного впливу глюкозотоксичності на тканини ока.
Ключові слова: цукровий діабет, алоксанова модель, діабетична ретинопатія, окисно-відновні ферменти.
Semenko V. V.1, Serdiuk V. M.1, 2, Savytskyi I. V.3
1Dnipropetrovsk Regional Clinical Ophthalmology Hospital, Dnipro, Ukraine
2Dnipropetrovsk Medical Academy of Health Ministry of Ukraine, Dnipo, Ukraine
3Odessa national medical university, Odessa, Ukraine
Research on enzymes activities by the cycle of krebs in eye's tissue at experimental diabetic retinopathy
Resume. Modelling of type 1 diabetes mellitus (DMТ1) is the basis for the new methods development for diabetic retinopathy treatment.
Goal. The goal of the study was the activity of succinate dehydrogenase (SDG), lactate dehydrogenase (LDG) and malate dehydrogenase (MDG) research to assess the energy metabolism condition in eyeball tissues with a background of a DMТ1 developed model.
Materials and methods. Diabetes was simulated with a triple intraperitoneal injection of alloxan at dose 7.5 ml / 200 g of animal weight. Introduction of alloxan was carried out with the background of free access to 5 % fructose solution.
Results. In the ganglionic layer differences in specific weight of animals were revealed in LDG activity analysis; differences in the activity of MDG, LDG, and SDG were revealed by high and very high enzyme activity classes. In the granular layer, differences were found between the group with the DMТ1 model and the control group in the specific weight of animals in SDG and LDG activity analysis. In the vascular layer, SDG and LDG activity differences were found in high and moderate activity class, and in very high enzymatic activity class in MDG and LDG activity analysis.
Conclusions. The obtained results indicate that during early stages of DMТ1 development there are significant changes in bioenergetics processes, which indicates the necessity to include in the debut of the disease metabolic profile drugs.
Keywords: diabetes mellitus, alloxan model, diabetic retinopathy, oxidation-reduction enzymes.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Прудиус П. Г. Поширеність діабетичної ретинопатії у хворих на цукровий діабет 1-го типу Вінницької області / П. Г. Прудиус, Н. В. Бондарчук, І. В. Семенюк // Міжнародний ендокринологічний журнал. – 2007. – № 2. – С. 44–46.
- Великий М. М. Вплив нікотинаміду на активність ферментів антиоксидантного захисту при експериментальному діабеті / М. М. Великий, В. А. Бурда, Н. Б. Биронт // Украинский биохимический журнал. – 1996. – № 2 (68). – С. 109–114.
- Шиманський I. О. Корекція нікотіноїл-ГАМК оксидативного стресу за діабетичної нейропатії / I. О. Шиманський, Т. М. Кучмеровська, Г. В. Донченко // Український біохімічний журнал. – 2002. – № 5 (74). – С. 89–95.
- Charron M. J. Implicating PARP and NAD depletion in type I diabetes / M. J. Charron, S. Bonner-Weir // Nat Med. – 1999. – Vol. 3. – P. 269–270.
- Камилов Р. Ф. Митохондрии как модель для оценки патохимических механизмов при воздействии химических загрязнителей, широко используемых в нефтехимической и нефтеперерабатывающей промышленности / Р. Ф. Камилов // Вятский медицинский вестник. – 2007. – № 4. – С. 108–111.
- Лойда З. Гистохимия ферментов. Лабораторные методы / 3. Лойда, Р. Госсрау, Т. Шиблер; пер. с англ. И. Б. Бухвалова и О. В. Копьева; под ред. Н. Т. Райхлина. – М. : Мир, 1982. – 272 с.
- Насибуллин Б. А. Гистохимически выявляемые изменения активности ферментов ЦТК в нейронах сенсомоторной коры крысы в динамике гипокинезии / Б. А. Насибуллин // Актуальні проблеми транспортної медицини. – 2006. – № 4 (6). – С. 126–131.
- Shapiro S. S. An analysis of variance test for normality (complete samples) / S. S. Shapiro, M. B. Wilk // Biometrika. – 1956. – Vol. 52 (3–4). – P. 591–611.
- Поляков И. В. Практическое пособие по медицинской статистике / И. В. Поляков, Н. С. Соколова. – Ленинград : Медицина, 1975. – 152 с.
- Епринцев А. Т. Углеводный метаболизм в печени крыс при пищевой депривации и экспериментальном диабете / А. Т. Епринцев, М. Ю. Шевченко, В. Н. Попов // Известия РАН, серия биологическая. – 2008. – № 1. – С. 115–118.
- Попов Е. М. Структурно-функциональная организация белков / Е. М. Попов. – М. : Наука, 1992. – 358 с.
- Буданцев А. Ю. Основы гистохимии : учебное пособие (компьютерный вариант) [Электронный ресурс] / А. Ю. Буданцев. – Пущино : Пущинский гос. ун-т, 2008. – Режим доступа: http://window.edu.ru/resource/159/59159
- Скулачев В. П. Эволюция, митохондрии и кислород / В. П. Скулачев // Соросовский образовательный журнал. – 1999. – № 9. – С. 1–7.
- Анаэробное образование сукцината и облегчение его окисления – возможные механизмы адаптации клетки к кислородному голоданию / Е. И. Маевский, Е. В. Гришина, А. С. Розенфельд [и др.] // Биофизика. – 2000. – Т. 45, № 3. – С. 509–513.
- Ашастин Б. В. Возможности поддержания митохондриального аппарата при гипоксии субстратами энергетического обмена / Б. В. Ашастин // Вестник ЮУрГУ. – 2012. – №. 42. – С.114–118.
- Пирс Э. Гистохимия. Теоретическая и прикладная / Э. Пирс; пер. с англ. Н. Абросимова, А. Баев, Ю. Васильев [и др.]; под ред. В. В. Португалова. – М. : Иностранная литература, 1962. – 962 с.
REFERENCES
- Prudius PG, Bondarchuk NV, Semenjuk ІV. [Prevalence of diabetic retinopathy among patients with type 1 diabetes mellitus in the Vinnytsia region]. Mіzhnarodnyi endokrynologіchnyi zhurnal. 2007;2:44–6. (in Ukrainian).
- Velykyi M, Burda V, Biront N. [Effect of nicotinamide on the activity of antioxidant defense enzymes in experimental diabetes]. Ukr.Biochem.J. 1996;2:109–14 (in Ukrainian).
- Shymanskyi I, Kuchmerovska T, Donchenko G. [Correction of nicotinoyl-GABA oxidative stress with diabetic neuropathy]. Ukr.Biochem.J. 2002;5:89–95. (in Ukrainian).
- Charron MJ, Bonner-Weir S. Implicating PARP and NAD depletion in type I diabetes. Nat Med. 1999;3:269–70.
- Kamilov R. [Mitochondria as a model for the evaluation of pathological mechanisms under the influence of chemical pollutants widely used in the petrochemical and oil refining industry]. Vyatskiy meditsinskiy vestnik. 2007;4:108–11. (in Russian).
- Lojda Z, Gossrau R, Schiebler TH. Enzyme Histochemistry: A Laboratory Manual. Raykhlin NT, editor. Moscow: Mir;1982. (in Russian).
- Nasibullin BA. [Histochemically revealed changes of enzymes CTA activity in neurones of rat brain sensomotoric cortex in the dynamics of hypokinesia]. Aktualni problemy transportnoi medytsyny. 2006;4:126–32. (in Russian).
- Shapiro SS, Wilk MB. An analysis of variance test for normality (complete samples). Biometrika. 1956;52(3–4):591–611.
- Polyakov IV, Sokolova NS. Practical guide on medical statistics. Moscow: Meditsina; 1975. (in Russian).
- Eprincev AT, Shevchenko MJu, Popov VN. [Carbohydrate metabolism in liver of rats with food deprivation and experimental diabetes]. Izvestiya RAN, seriya biologicheskaya. 2008;1:115–8. (in Russian).
- Popov EM. Structural and functional organization of proteins. Moscow: Science; 1992. (in Russian).
- Budancev AJu. Fundamentals of histochemistry: Textbook [Internet]. Pushchino: Pushhinskij gos. un-t; 2008 [cited 2008 Jul 9]. Available at: http://window.edu.ru/resource/159/ 59159. (in Russian).
- Skulachev VP. [Evolution, mitochondria and oxygen]. Sorosovskiy obrazovatelnyy zhurnal. 1999;9:1–7. (in Russian).
- Maevskiǐ EI, Grishina EV, Rozenfel'd AS, Ziakun AM, Vereshchagina VM, Kondrashova MN. [Anaerobic formation of succinate and facilitation of its oxidation - possible mechanisms of cell adaptation to oxygen defciency]. Biofzika. 2000;3: 509–13. (in Russian).
- Ashastin BV. [Possibilities of maintaining the mitochondrial apparatus during hypoxia by substrates of energy metabolism]. Vestnik JuUrGU. 2012;42:114–8. (in Russian).
- Pearse AGE. Histochemistry: Theoretical and Applied. Moscow: Foreign literature; 1962. (in Russian).
Стаття надійшла в редакцію 11.04.2018 р.
Рецензія на статтю надійшла в редакцію 15.05.2018 р.