- Автор: Super User
- Категорія: № 2 (07) 2017
- Опубліковано: 17 квітня 2018
- Перегляди: 4649
УДК 617.764−008.811.4−02−092:617.7−007.681−085.225.2.84
Абышева Л. Д.1, Авдеев Р. В.2, Александров А. С.3, Арапиев М. У.4, Бакунина Н. А.5, Баранова Н. А.3, Басинский А. С.6, Брежнев А. Ю.7, Газизова И. Р.8, Галимова А. Б.9, Гапонько О. В.3, 10, Гарькавенко В. В.11, Гетманова А. М.12, Городничий В. В.3, Гусаревич А. А.13, Дорофеев Д. А.14, Жаворонков С. А.15, Завадский П. Ч.16, Захарова М. А.3, Захидов А. Б.17, Зверева О. Г.18, 19, Исаков И. Н.20, Каримов У. Р.21, Кондракова И. В.3, Куроедов А. В.3, 10,Ланин С. Н.22,Ловпаче Дж. Н.4, Лоскутов И. А.23, Молчанова Е. В.24, Нагорнова З. М.25, Онуфрийчук О. Н.26, Петров С. Ю.27, Рожко Ю. И.28,Селезнев А. В.25,Таштитова Л. Б.1,Хохлова А. С.29,Шапошникова И. В.30, Шахалова А. П.31
1КазНИИ ГБ, г. Алматы, Казахстан;
2ГБОУ ВПО «ВГМА им. Н. Н. Бурденко», г. Воронеж, Россия;
3ФКГУ «МУНКЦ им. П. В. Мандрыка» МО РФ, г. Москва, Россия;
4ФГБУ «МНИИ ГБ им. Гельмгольца», г. Москва, Россия;
5ГКБ № 1 им. Н. И. Пирогова, г. Москва, Россия;
6ООО «Офтальмологический центр проф. Басинского С. Н.», г. Орел, Россия;
7ФГБОУ ВО «Курский ГМУ» МЗ РФ, г. Курск, Россия;
8ФГБУ СЗФМИЦ МЗ РФ, г. Санкт-Петербург, Россия;
9ФГБУ «Всероссийский центр глазной и пластической хирургии» МЗ РФ, г. Уфа, Россия;
10ГБОУ ВПО «РНИМУ им. Н. И. Пирогова» Минздрава России, г. Москва, Россия;
11ГОУ ВПО «КГМУ им. проф. В. Ф. Войно-Ясенецкого», г. Красноярск, Россия;
12Областная больница № 1, отделение микрохирургии глаза, г. Брянск, Россия;
13НУЗ «Дорожная клиническая больница» ОАО «РЖД»; Междорожный центр микрохирургии глаза, г. Новосибирск, Россия;
14ГБУЗ ОКБ № 3, г. Челябинск, Россия;
15ГБУЗ «Городская клиническая больница № 15 им. О. М. Филатова», г. Москва, Россия;
16ИМФУП «Медицинский центр “Новое зрениеˮ», г. Минск, Беларусь;
17Клиника микрохирургии глаза ЧП «SAIF OPTIMA», г. Ташкент, Узбекистан;
18ГАУЗ РКОБ МЗРТ, г. Казань, Россия;
19ГБОУ ДПО КГМА, г. Казань, Россия;
20АО «НЗРМК им. Н. Е. Крюкова», г. Новокузнецк, Россия;
21Сырдарьинская областная офтальмологическая больница, г. Гулистан, Узбекистан;
22КГБУЗ «ККОКБ им. П. Г. Макарова», г. Красноярск, Россия;
23Научно-клинический центр ОАО «РЖД», г. Москва, Россия;
24ГБОУ ВПО ГМА, г. Омск, Россия;
25ГБОУ ВО ИвГМА, г. Иваново, Россия;
26ГБУЗ ДЦ № 7 (глазной), г. Санкт-Петербург, Россия;
27ФГБНУ «НИИ глазных болезней», г. Москва, Россия;
28ГУ РНПЦ РМ и ЭЧ, УО ГомГМУ, г. Гомель, Беларусь;
29ФГБОУ ВО ТГМУ, г. Владивосток, Россия;
30КОЦ «Хорошее зрение», г. Кемерово, Россия;
31ЦЛКЗ «Тонус Амарис», г. Нижний Новгород, Россия
Цель. Определить характеристики возникновения и прогрессирования синдрома сухого глаза (ССГ) у пациентов с первичной открытоугольной глаукомой (ПОУГ) в зависимости от стадии заболевания, режимов лечения и возраста пациентов.
Материал и методы. В итоговый протокол комбинированного аналитического многоцентрового когортного исследования, проведенного в январе–мае 2016 г., были включены данные 530 человек (866 глаз). Основную группу составили 398 пациентов, страдающих ПОУГ, группу сравнения – 132 человека без признаков глаукомного процесса. Офтальмологическое обследование включало измерение внутриглазного давления, исследование морфометрических и функциональных показателей. Специальные пробы и тесты для оценки наличия и степени выраженности ССГ включали определение времени разрыва слезной пленки (проба Норна) и определение величины суммарной слезопродукции (тест Ширмера), окраску витальным красителем лиссаминовым зеленым, определение индекса патологии поверхности глаз.
Результаты. Установлено, что среди лиц, больных с глаукомой, в сравнении с показателем в общей популяции, в возрастных группах 51–60, 61–70 и 71–80 лет клинические проявления ССГ встречаются чаще на 9,5, 27,8 и 5,2 % соответственно. Стабильность прероговичной слезной пленки во всех возрастных категориях у больных с глаукомой была статистически значимо меньше, чем у лиц из группы сравнения (p < 0,05). Результаты теста Ширмера были ниже у глаукомных больных по сравнению с контрольной группой в целом, с достижением статистически значимых различий в возрастных подгруппах 41–50 и 61–70 лет (p < 0,05). Частота и выраженность повреждений эпителия бульбарной конъюнктивы и роговицы, определяемые при использовании лиссаминового зеленого, у лиц на фоне медикаментозной терапии глаукомы были выше (p < 0,05). Не установлено корреляции между степенью выраженности проявлений ССГ по результатам классических тестов (Ширмера и Норна) и стадией глаукомы. Степень выраженности объективных симптомов ССГ зависит от режима медикаментозной терапии. Наибольшее угнетение показателей слезопродукции и стабильности прероговичной слезной пленки характерно для максимальных режимов (двух и более препаратов), сопровождающихся максимальной кратностью инстилляций в течение суток. Интенсивность жалоб на этапе финального обследования прямо пропорциональна длительности медикаментозной терапии глаукомы.
Заключение. Необходимо учитывать возможные перспективы развития и прогрессирования ССГ при планировании стратегии медикаментозного лечения глаукомы. Это позволит минимизировать степень дискомфорта, улучшить качество жизни, комплаентность данной категории больных и в конечном итоге обеспечить более качественную и эффективную терапию основного заболевания.
Ключевые слова: глаукома, синдром сухого глаза, патология глазной поверхности, режимы назначений.
ВВЕДЕНИЕ
Более 60 млн человек во всем мире страдают от глаукомы, и, согласно прогнозам, эта цифра увеличится почти до 80 млн к 2020 году [1]. По данным ряда исследований, до 40 % больных глаукомой используют более одного лекарственного препарата для достижения компенсации внутриглазного давления (ВГД) [2]. Местная гипотензивная терапия, являющаяся единственной доказанной эффективной стратегией лечения заболевания, нередко ассоциируется с симптомами воспаления, аллергическими реакциями, нарушением стабильности прероговичной слезной пленки и другими разнообразными клиническими проявлениями синдрома сухого глаза (ССГ), объединяемыми в настоящее время термином «патология глазной поверхности». В течение последних десятилетий ХХ в. глаукома и ССГ, негативно влияющие на качество жизни больных, явно вышли за рамки медицинской проблемы и стали рассматриваться как социально-экономические проблемы, что накладывает на специалистов обязательства перед пациентами не только по прогнозированию течения и возможных вариантов исходов данных заболеваний, но и по оценке стоимости их лечения [3, 4]. Сведения о распространенности ССГ среди глаукомных пациентов многочисленны, но весьма неоднородны [5, 6]. Основным фактором развития ССГ у больных с первичной открытоугольной глаукомой (ПОУГ) считается длительное воздействие на эпителий глазной поверхности и функцию железистых клеток конъюнктивы офтальмогипотензивных глазных капель, при этом отсутствуют убедительные доказательства патогенетической связи непосредственно глаукомного процесса с развитием ССГ [7–9].
ЦЕЛЬ РАБОТЫ
Определить характеристики возникновения и прогрессирования ССГ у пациентов с ПОУГ в зависимости от стадии заболевания, режимов лечения и возраста пациентов.
МАТЕРИАЛ И МЕТОДЫ
В итоговый протокол комбинированного аналитического многоцентрового когортного исследования, проведенного в период с января по май 2016 года на 31 научно-клинической базе 4 стран (Беларусь, Казахстан, Россия, Узбекистан), были включены данные 530 человек (866 глаз; женщин – 330 (62,3 %), мужчин – 200 (37,3 %)), что составило 94,3 % от общего числа полученных исследователями анкет. Исключенные анкеты содержали ошибки вследствие дублирования данных и неверной трактовки критериев включения/исключения. Основную группу составили 398 пациентов, страдающих ПОУГ, группу сравнения – 132 человека без признаков глаукомного процесса. Для заполнения базы данных были использованы лицензированные персонализированные возможности технологии Google и Microsoft (США) с предварительной кодировкой результатов для исключения нарушения норм действующего законодательства. Участие пациентов в исследовании было подтверждено их письменным согласием.
Ретроспективный компонент исследования включал изучение анамнеза заболевания от момента установления диагноза. Во всех случаях диагноз был установлен в соответствии с системой дифференциальной диагностики заболеваний и подтвержден специальными методами исследования. Стадия глаукомы на момент первичного диагностирования заболевания устанавливалась по данным медицинской документации (результаты тонометрии, офтальмоскопии и разных видов периметрии). На момент включения в исследование проводилась дополнительная документальная верификация стадии заболевания (согласно действующей классификации глаукомы) с дополнительным измерением уровня ВГД (тонометрия по Маклакову грузом 10 г), исследованием морфометрических и функциональных показателей. Все клинические исследования, подразумевающие измерение офтальмотонуса, на момент включения в исследование проводились в интервале от 9.00 до 12.00. Степень компенсации офтальмотонуса была рассчитана согласно официальным рекомендациям Российского глаукомного общества, в которых приведены оптимальные характеристики верхних границ офтальмотонуса у больных с глаукомой на фоне лечения [10, 11].
Специальные пробы и тесты для оценки наличия и степени выраженности ССГ включали определение времени разрыва слезной пленки (ВРСП) (проба Норна) и определение величины суммарной слезопродукции (тест Ширмера), окраску витальным красителем лиссаминовым зеленым (с оценкой по шкале Oxford), определение индекса патологии поверхности глаз (Ocular Surface Disease Index, OSDI). Инвазивные исследования глазной поверхности проводились в течение одного исследования, с интервалами от 15 мин и более.
Критерии включения в основную группу: пациенты европеоидной расы с начальной, развитой или далеко зашедшей стадиями ПОУГ, с длительностью заболевания не менее 6 мес. на момент финального осмотра; возраст пациентов – от 40 до 89 лет; клиническая рефракция – ± 6,0 диоптрий, астигматизм – ± 3,0 диоптрии. На момент финального обследования пациенты могли получать любую антиглаукомную гипотензивную терапию или не получать ее по причине удачно выполненной антиглаукомной операции.
Критерии исключения: пациенты с любой другой формой ПОУГ и клинической рефракцией, нежели указано выше; выраженные помутнения оптических сред, затрудняющие использование морфометрических или периметрических методов исследования или приводящие к неправильной трактовке их результатов; пациенты с любыми другими заболеваниями сетчатки (например, возрастная макулодистрофия, сухая форма (начиная со ІІ стадии по классификации AREDS (2001)), состояния после окклюзий и осложнений диабетической ретинопатии, влажная форма макулодистрофии, в т. ч. на фоне интравитреальных инъекций препаратами – ингибиторами ангиогенеза и др.); пациенты с травмами и заболеваниями органа зрения в анамнезе, затрудняющими проведение тонометрии; пациенты после проведенной интракапсулярной экстракции катаракты, классической экстракапсулярной экстракции катаракты или факоэмульсификации, прошедших с осложнениями и в случае наличия послеоперационного астигматизма более ± 3,0 диоптрий; пациенты с любой формой отслойки сетчатки (оперированная или неоперированная); пациенты с общими (системными) заболеваниями, требующими гормональной терапии, как это принято согласно методике проведения клинических исследований (https://clinicaltrials.gov).
МЕТОДЫ СТАТИСТИЧЕСКОГО АНАЛИЗА
Обработка полученных данных проводилась одним исследователем с использованием программы Statistica 8.0 (StatSoft Inc., США) с последующей системной проверкой полученных результатов и обсуждением двумя другими исследователями в независимом режиме. Приводимые параметры, имеющие нормальное распределение, представлены в формате М ± m, где М – среднее значение, m – стандартная ошибка среднего значения. Распределение количественных параметров приведено в соответствии с W-критерием Шапиро – Уилка. Параметры, имеющие распределение, отличное от нормального, представлены в формате Мe (Q25 %; Q75 %), где Мe – медиана, а Q25 % и Q75 % – квартили. При нормальном распределении параметров для сравнения двух независимых групп или повторных внутригрупповых изменений использовался t-критерий Стьюдента. В случае отличного от нормального распределения параметров при сравнении нескольких независимых выборок использовался анализ для попарного сравнения двух независимых выборок – Z-аппроксимация U-критерия Манна – Уитни, для повторных внутригрупповых сравнений применялась Z-аппроксимация T-критерия Вилкоксона. Для проверки равенства медиан нескольких выборок применяли H-критерий Краскела – Уоллеса. Критический уровень значимости при проверке статистических гипотез принимался < 0,05. Для проведения многомерной классификации данных и деления совокупности объектов на однородные группы был использован кластерный анализ с применением метода k-средних.
РЕЗУЛЬТАТЫ
На момент финального обследования медиана возраста пациентов основной группы составила 68,45 (62,7; 74,5) года, в группе сравнения – 60,9 (52,00; 68,8) года (p < 0,001). Гендерных различий в основной и контрольной группах не установлено (таблица 1). Возраст пациентов с глаукомой на момент диагностирования заболевания составил 63,60 (57,20; 69,20) года, средняя длительность заболевания – 4,00 (2,00; 6,60) года.
На этапе заключительного обследования начальная стадия заболевания диагностирована у 215 больных (50,2 %), развитая – у 164 (38,3 %), далеко зашедшая – у 49 (11,5 %).
Одним из ключевых моментов, определяющих выбор стартовой медикаментозной терапии глаукомы и влияющих на коррекцию и смену гипотензивного режима, является, наряду с морфофункциональными характеристиками зрительного анализатора, уровень офтальмотонуса и его соответствие рекомендованным значениям. В свою очередь это прямо или косвенно может определять интенсивность негативного воздействия медикаментов на прероговичную слезную пленку, а значит и на особенности формирования картины ССГ. В предыдущих исследованиях неоднократно демонстрировалось, что на момент обнаружения болезни уровень ВГД статистически достоверно варьирует в зависимости от стадии заболевания [12–22]. Уровень ВГД на момент обнаружения глаукомы в настоящем исследовании также достоверно отличался в зависимости от стадии (от 27 до 30 мм рт. ст., p < 0,001), на фоне проводимого лечения к моменту финального обследования офтальмотонус статистически значимо снизился (p < 0,001). Однако, исходя из рекомендованных в «Национальном руководстве по глаукоме для практикующих врачей» значений офтальмотонуса в зависимости от стадии заболевания, доля лиц с достигнутыми «целевыми показателями» составила для начальной глаукомы 95,9 %, для развитой – 74,1 %, для далеко зашедшей – лишь 36 % [11]. На момент финального исследования у всех пациентов с глаукомой использовались 44 различных режима лечебных мероприятий, которые состояли из одного или нескольких компонентов: бета-блокаторы (ББ), аналоги простагландинов (ПГ), ингибиторы карбоангидразы (ИКА), холиномиметики (ХМ) в виде глазных капель; лазерное (трабекулопластика) или хирургическое (синустрабекулэктомия) лечение в анамнезе. Анализ функциональных показателей слезы продемонстрировал, что у лиц основной группы значения изучаемых параметров были статистически значимо ниже, чем в контрольной группе. С учетом исходных различий в возрастных характеристиках лиц с ПОУГ и в группе сравнения, возраст-ассоциированного характера ССГ и с целью корректного сравнения количественных и качественных показателей все пациенты были разделены на возрастные подгруппы по декадам жизни (41–50, 51–60 лет и т. д.).
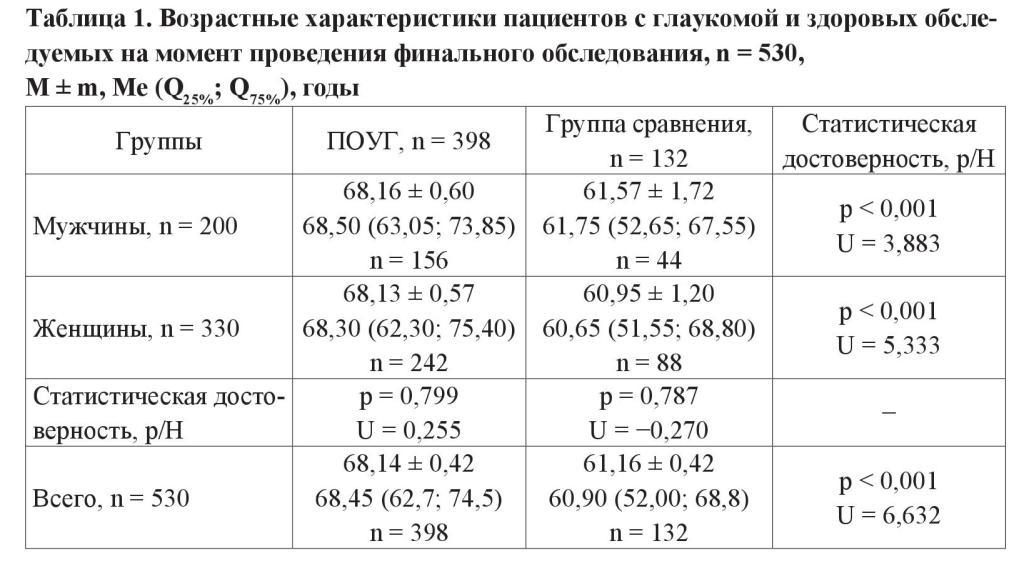
Показатель суммарной слезопродукции (тест Ширмера) у пациентов с глаукомой был снижен в сравнении с лицами без признаков заболевания (12,40 ± 0,28 и 15,58 ± 0,45 мм соответственно). Подобная закономерность прослеживалась во всех возрастных группах, достигая статистически значимых различий у лиц 41–50 и 61–70 лет (p < 0,05) (рисунок 1).
Различия между основной и контрольной группами сохранялись как среди мужчин, так и среди женщин после стратификации исследуемых групп по полу, при этом внутри групп гендерных различий по результатам теста Ширмера не отмечено (p > 0,05).
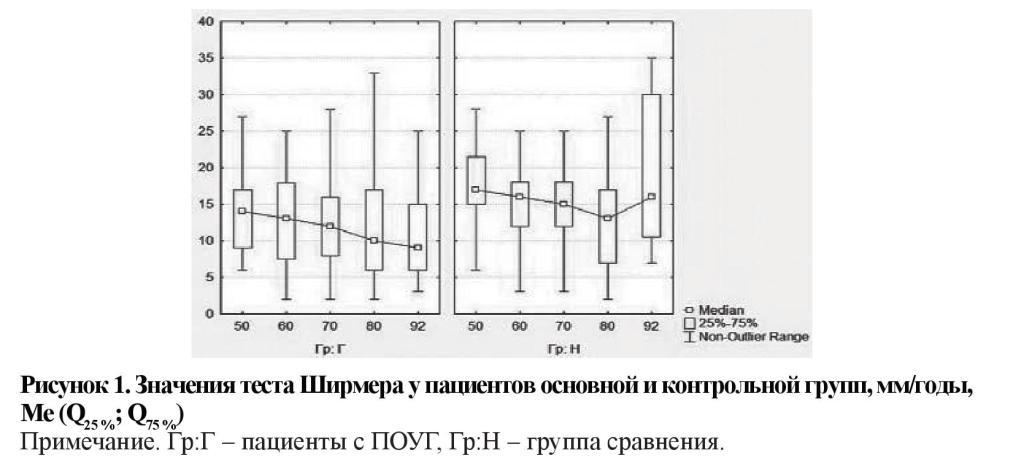
Среднее значение ВРСП у пациентов с глаукомой также оказалось сниженным в сравнении с показателем в контрольной группе (7,34 ± 0,15 и 9,86 ± 0,29 с соответственно). Во всех возрастных подгруппах различия были статистически значимы (рисунок 2).
Одним из тестов, направленных на объективизацию диагностики роговичноконъюнктивального ксероза, является использование витальных красителей (флюоресцеина натрия, бенгальского розового, лиссаминового зеленого). Степень тяжести эпителиопатии, ассоциированной с ССГ, оценивается в баллах и позволяет количественно оценить степень выраженности повреждения. Важной диагностической особенностью лиссаминового зеленого считается то, что он окрашивает главным образом клетки с поврежденной мембраной и/или безжизненные клетки, являясь наиболее информативным диагностическим красителем. Как видно из таблицы 2, интенсивность окрашивания в обеих изучаемых группах увеличивается с возрастом, при этом выявляемая степень тяжести поражения статистически значимо выше во всех возрастных группах, за исключением лиц 41–50 лет.
Еще одним интегральным показателем, который признан стандартизированным документом и разработан для оценки субъективного состояния глазной поверхности и степени выраженности ССГ, служит опросник OSDI (Ocular Surface Disease Index, индекс заболевания глазной поверхности). Согласно результатам исследования, симптомы зрительного дискомфорта, характерные для ССГ, чаще встречались у пациентов с глаукомой в каждой из возрастных групп. Различия достигали статистической значимости у лиц 41–50, 51–60 и 61–70 лет. Любопытными представляются результаты анализа частоты встречаемости жалоб, характерных для ССГ, у лиц различного возраста. В общей популяции (контрольная группа) этот показатель имеет возраст-ассоциированный характер, достигая максимума у лиц старше 80 лет (87,5 % опрошенных), что соотносится с представлениями о прогрессирующем ухудшении состояния прероговичной слезной пленки, как проявлении физиологического старения. А вот среди глаукомных больных наиболее часто подобные жалобы предъявляют лица в возрасте 41–50 лет (88,9 % больных), значительно превосходя результаты в старших возрастных группах. В последующих декадах жизни динамика данного показателя приобретает привычный возраст-зависимый вид. В целом доля лиц с признаками ССГ, и диагностированной глаукомой, более чем на 23 % превышает результат в группе сравнения (таблица 3).
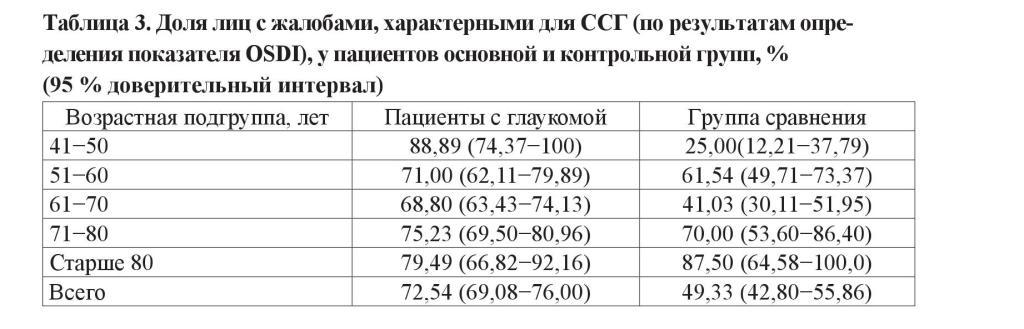
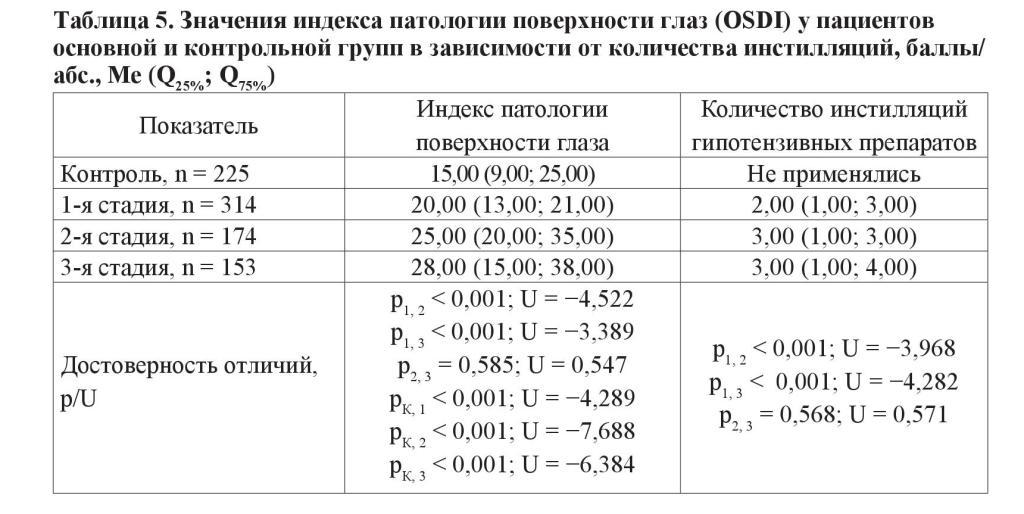
Не установлено влияния стадии глаукомного процесса на результаты пробы Ширмера и ВРСП у пациентов основной группы. В то же время присутствует тенденция к увеличению степени прокрашивания эпителия передней поверхности глаза с прогрессированием заболевания. Выраженная эпителиопатия (≥ 2 баллов по шкале Oxford) у пациентов с далеко зашедшей стадией встречается на 14 % чаще, чем у больных с начальной стадией заболевания (таблица 4).
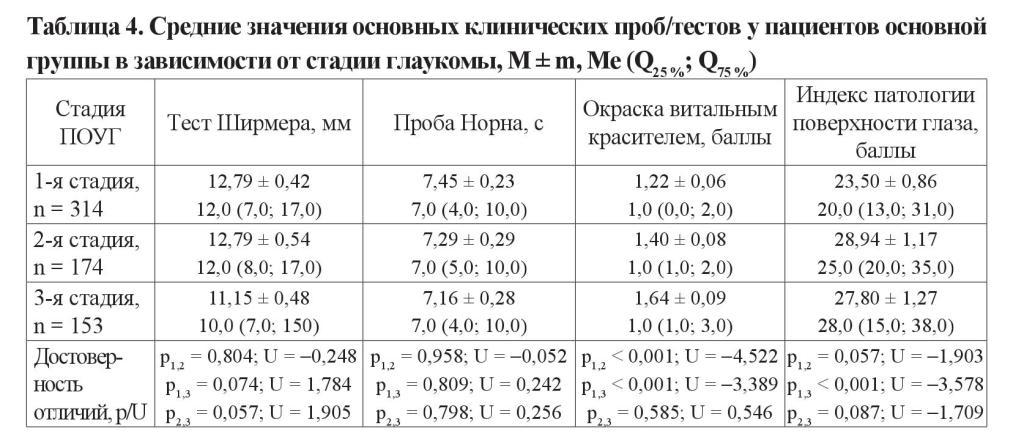
Изучена взаимосвязь степени выраженности клинических проявлений ССГ и режимов местной гипотензивной терапии у пациентов с глаукомой. Для анализа использованы наиболее популярные режимы медикаментозной терапии: монотерапия ББ, монотерапия ПГ, сочетание ББ + ПГ, сочетание ББ + ИКА, комбинация ББ + ПГ + ИКА. С учетом предполагаемого влияния длительности инстилляций на выраженность ССГ, а также ранее полученных данных, касающихся продолжительности использования различных режимов гипотензивной терапии от старта до их коррекции или смены, все пациенты были разделены, исходя из анамнестических данных, на две подгруппы: со сроком существования болезни 0,5–2 года и от 2 до 4 лет [23].
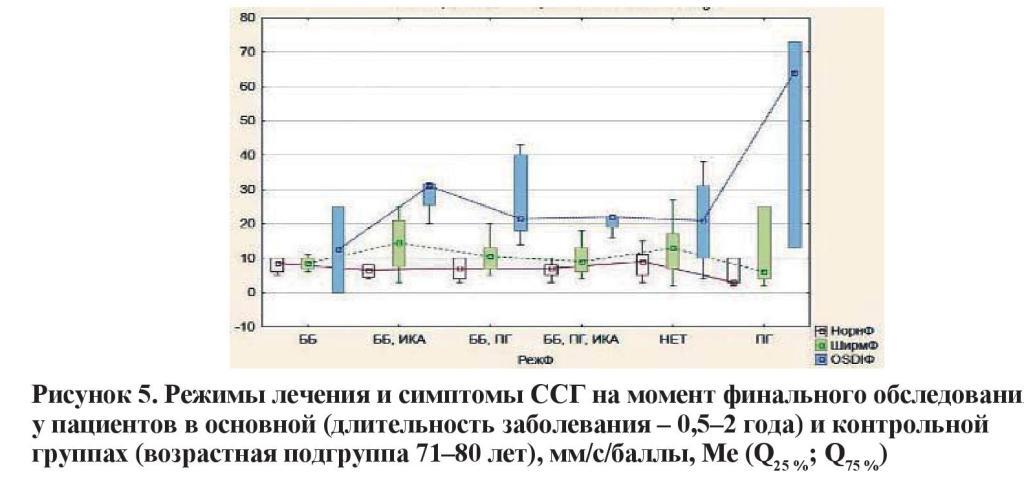
Данные по первой из указанных групп представлены графически на рисунках 3–5, характеризующих основные функциональные параметры (тест Ширмера и проба Норна) и показатель OSDI в зависимости от возраста исследуемых. Очевидно, что наибольшее угнетение суммарной слезопродукции и нарушение ВРСП соответствуют режиму с максимальным количеством инстилляций (ББ + ПГ + ИКА). Значительное нарушение данных показателей отмечено и на фоне использования комбинации ББ + ПГ. Любопытно, что эти результаты в отдельных возрастных группах вступают в диссонанс с субъективно оцениваемым индексом OSDI. Так, у лиц в возрасте 51–60 и 71–80 лет наибольшее количество жалоб отмечалось на фоне монотерапии аналогами простагландинов.
Режимы лечения и симптомы ССГ на момент финального обследования у пациентов в основной (длительность заболевания – 0,5–2 года) и контрольной группах (возрастная подгруппа 61–70 лет), мм/с/баллы, Ме (Q25 %; Q75 %).
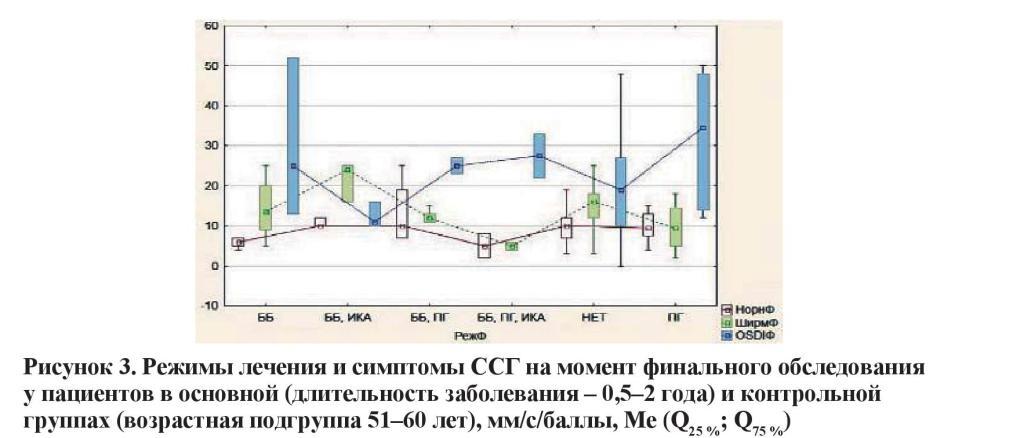
Схожая ситуация наблюдается у лиц с длительностью заболевания 2–4 года. Гипотензивный режим, включающий сочетание препаратов трех групп с максимальным количеством инстилляций в течение суток, характеризовался наиболее выраженным угнетением функциональных показателей слезы и прероговичной слезной пленки. Значительная выраженность проявлений ССГ также ассоциировалась с комбинацией ББ + ПГ.
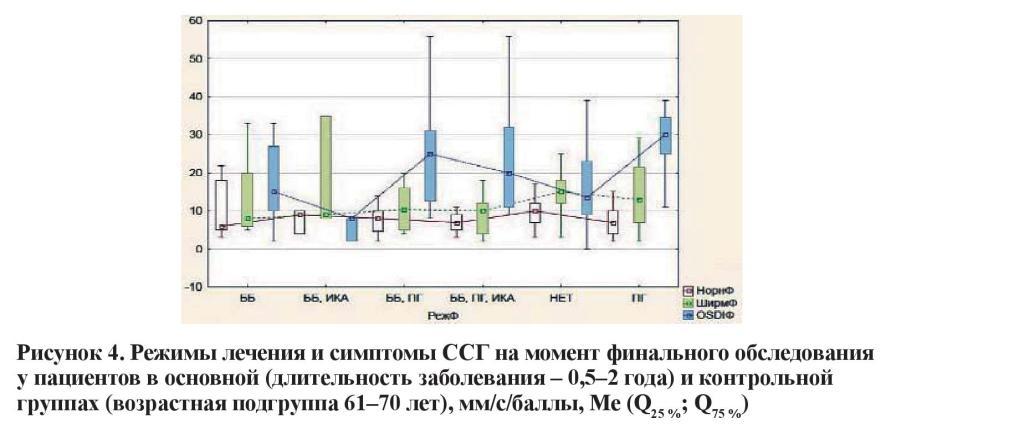
Наконец, проанализирована зависимость проявлений ССГ от количества инстилляций гипотензивных препаратов. Следует отметить, что начальная, развитая и далеко зашедшая стадии глаукомы объяснимо отличались по количеству используемых препаратов и кратности их использования. Показатель OSDI оказался статистически значимо выше в продвинутых стадиях заболевания в сравнении с начальной глаукомой. В свою очередь, разница в субъективной симптоматике ССГ между развитой и далеко зашедшей стадиями не достигала статистической значимости (таблица 5).
ЗАКЛЮЧЕНИЕ
Комбинированное аналитическое многоцентровое когортное исследование по изучению развития и прогрессирования ССГ у пациентов с разными стадиями глаукомы было проведено на 31 клинической базе в 4 странах СНГ (Беларусь, Казахстан, Россия, Узбекистан) с привлечением 38 специалистов, что по праву позволяет отнести эту работу к одной из крупнейших на постсоветском пространстве, выполненных и опубликованных в последнее десятилетие.
В рамках исследования у лиц с глаукомой установлены уменьшение слезопродукции, снижение стабильности слезной пленки, изменение клеток бульбарной конъюнктивы и определено большее количество жалоб (по опроснику OSDI) по сравнению с данными контрольной группы. Сравнительный анализ проводился в соответствующих возрастных когортах, сформированных по декадам жизни, что позволило избежать возможных проблем, связанных с различиями в среднем возрасте лиц основной и контрольной групп. Показано, что среди лиц, больных глаукомой, в сравнении с показателем в общей популяции, в возрастных группах 51–60, 61–70 и 71–80 лет клинические проявления ССГ встречаются чаще на 9,5, 27,8 и 5,2 % соответственно.
Подтверждена значимость функциональных методов диагностики ССГ. Стабильность прероговичной слезной пленки во всех возрастных категориях у больных глаукомой была статистически значимо меньше, чем у лиц из группы сравнения (p < 0,05). Оценка продукции слезной жидкости (тест Ширмера) продемонстрировала снижение данного показателя у глаукомных больных по сравнению с контрольной группой, с достижением статистически значимых различий в возрастных подгруппах 41–50 и 61–70 лет (p < 0,05). Частота и степень выраженности повреждений эпителия бульбарной конъюнктивы и роговицы, определяемые при использовании витального красителя лиссаминового зеленого, у лиц на фоне медикаментозной терапии глаукомы были выше (p < 0,05). Не установлено корреляции между степенью выраженности проявлений ССГ по результатам классических тестов (Ширмера и ВРСП) и стадией глаукомы, что может служить подтверждением предположения об отсутствии патогенетической связи непосредственно глаукомного процесса с развитием ССГ.
Степень выраженности объективных симптомов ССГ зависит от режима медикаментозной терапии. Наибольшее угнетение показателей слезопродукции и стабильности прероговичной слезной пленки характерно для максимальных режимов (два и более препаратов), сопровождающихся наибольшей кратностью инстилляций в течение суток. Интенсивность жалоб на этапе финального обследования прямо пропорциональна длительности медикаментозной терапии глаукомы.
Полученные данные с определенностью позволяют говорить о необходимости учитывать возможные перспективы развития и прогрессирования ССГ при планировании стратегии медикаментозного лечения глаукомы. Это позволит минимизировать степень дискомфорта, улучшить качество жизни, комплаентность данной категории больных и в конечном итоге обеспечить более качественную и эффективную терапию основного заболевания.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- An assessment of the health and economic burdens of glaucoma / R. Varma, P. P. Lee, I. Goldberg, S. Kotak // Am. J. Ophthalmol. – 2011. – Vol. 152(4). – P. 515–522.
- Adherence in glaucoma: objective measurements of once-daily and adjunctive medication use / A. L. Robin, G. D. Novack, D. W. Covert, [et al.] // Am. J. Ophthalmol. – 2007. – Vol. 144(4). – P. 533–540.
- Голубев С. Ю. К вопросу о выборе экономически эффективного препарата для профилактики и лечения синдрома «сухого глаза» / С. Ю. Голубев, А. В. Куроедов // Синдром «сухого глаза». – 2002. – № 3. – С. 12–14.
- The epidemiology of dry eye disease: report of the Epidemiology Subcommittee of the International Dry Eye WorkShop (2007) // The ocular surface. – 2007. – Vol. 5(2). – P. 93–107.
- Бржеский В. В. Глаукома и синдром «сухого глаза» / В. В. Бржеский, М. Радхуан // Офтальмологические ведомости. – 2014. – Т. 7, № 2. – С. 37–49.
- Брежнев А.Ю. Псевдоэксфолиативный синдром как фактор риска развития синдрома «сухого глаза» / А. Ю. Брежнев, В. И. Баранов, С. Ю. Петров // РМЖ. Клиническая офтальмология. – 2016. – Т. 17, № 1. − С. 30–34.
- Бржеский В. В. Синдром «сухого глаза» и заболевания глазной поверхности: клиника, диагностика, лечение / В. В. Бржеский, Г. Б. Егорова, Е. А. Егоров. – М. : ГЭОТАРМедиа, 2016. – 464 с.
- Бржеский В. В. Роговично-конъюнктивальный ксероз / В. В. Бржеский, Е. Е. Сомов. – СПб., 2003. – 119 с.
- Егоров Е. А. Нежелательные эффекты офтальмогипотензивной терапии: синдром «сухого глаза» / Е. А. Егоров, В. В. Бржеский, Н. В. Муратова // Новости глаукомы. – 2009. – № 3. – С. 3–5.
- Егоров Е. А. Глаукома. Национальное руководство / Е. А. Егоров. – М. : ГЭОТАРМедиа, 2013. – 824 с.
- Егоров Е. А. Национальное руководство по глаукоме / Е. А. Егоров, Ю. С. Астахов, В. П. Еричев. – М. : ГЭОТАР-Медиа, 2015. – 456 с.
- Егоров Е. А. Отдельные клинико-эпидемиологические характеристики глаукомы в странах СНГ и Грузии. Результаты многоцентрового открытого ретроспективного исследования (часть 1) / Е. А. Егоров, А. В. Куроедов // Клиническая офтальмология. – 2011. – № 3. – С. 97–100.
- Егоров Е. А. Отдельные клинико-эпидемиологические характеристики глаукомы в странах СНГ и Грузии. Результаты многоцентрового открытого ретроспективного исследования (часть 2) / Е. А. Егоров, А. В. Куроедов // Клиническая офтальмология. – 2012. – № 1. – C. 19–22.
- Факторы риска, патогенные факторы развития и прогрессирования глаукомы по результатам многоцентрового исследования Российского глаукомного общества / Р. В. Авдеев, А. С. Александров, А. С. Басинский [и др.] // Медико-биологические проблемы жизнедеятельности. – 2012. – № 2 (8). – С. 57–69.
- Степень взаимного влияния и характеристики морфофункциональных взаимоотношений между первичной открытоугольной глаукомой и макулодистрофией / Р. В. Авдеев, А. С. Александров, А. С. Басинский [и др.] // Офтальмологические ведомости. – 2014. – Т. 7, № 1. – С. 19–27.
- Прогнозирование продолжительности сроков заболевания и возраста пациентов с разными стадиями первичной открытоугольной глаукомы / Р. В. Авдеев, А. С. Александров, Н. А. Бакунина [и др.] // Национальный журнал глаукома. – 2014. – Т. 13, № 2. – С. 60–69.
- Многоцентровое исследование по изучению показателей офтальмотонуса у пациентов с продвинутыми стадиями первичной открытоугольной глаукомы на фоне проводимого лечения / Л. Д. Абышева, Р. В. Авдеев, А. С. Александров [и др.] // Офтальмологические ведомости. – 2015. – Т. 8, № 1. – С. 43–60.
- Результаты изучения соотношения эффективности и стоимости затрат при применении местной гипотензивной терапии у пациентов с продвинутыми стадиями первичной открытоугольной глаукомы (многоцентровое исследование) / А. В. Куроедов, Л. Д. Абышева, Р. В. Авдеев [и др.] // Российский офтальмологический журнал. – 2015. – Т. 8, № 3. – С. 10–22.
- Оптимальные характеристики верхней границы офтальмотонуса у пациентов с развитой стадией первичной открытоугольной глаукомы с точки зрения доказательной медицины / Л. Д. Абышева, Р. В. Авдеев, А. С. Александров [и др.] // РМЖ. Клиническая офтальмология. – 2015. – Т. 16, № 3. – С. 111–123.
- Первичная открытоугольная глаукома: в каком возрасте пациента и при какой длительности заболевания может наступить слепота / А. В. Куроедов, Р. В. Авдеев, А. С. Александров [и др.] // Медико-биологические проблемы жизнедеятельности. – 2014. – № 2(12). – С. 74–84.
- Модель манифестирования и исходов первичной открытоугольной глаукомы / Р. В. Авдеев, А. С. Александров, Н. А. Бакунина [и др.] // Клиническая медицина. – 2014. – Т. 92, № 12. – С. 64–72.
- Многоцентровое исследование по определению структурно-функционального статуса зрительного анализатора при одновременном наличии в глазу глаукомы и возрастной макулярной дегенерации с выявлением их корреляционных связей и степени взаимного влияния / Р. В. Авдеев, А. С. Александров, А. С. Басинский [и др.] // Офтальмология. Восточная Европа. – 2013. – № 4. – С. 15–25.
- Оптимизация лечебно-диагностического процесса у пациентов с первичной открытоугольной глаукомой / Л. Д. Абышева, А. С. Александров, М. У. Арапиев [и др.] // Национальный журнал глаукома. – 2016. – Т. 15, № 2. – С. 19–35.
REFERENCES
- Varma R, Lee PP, Goldberg I, Kotak S. An assessment of the health and economic burdens of glaucoma. Am. J. Ophthalmol. 2011;152(4):515–522.
- Robin AL, Novack GD, Covert DW, et al. Adherence in glaucoma: objective measurements of once-daily and adjunctive medication use. Am. J. Ophthalmol. 2007;144(4):533–540.
- Golubev SYu, Kuroyedov AV. [Choice of cost-effective medicine for the prevention and treatment of dry eye syndrome]. «Dry Eye» syndrome. 2002;3:12–14. (in Russian).
- The epidemiology of dry eye disease: report of the Epidemiology Subcommittee of the International Dry Eye WorkShop (2007). The ocular surface. 2007;5(2):93–107.
- Brzheskij VV, Radukhan M. [Glaucoma and the «dry eye» syndrome]. Ophthalmology J. 2014;7(2):37–49. (in Russian).
- Brezhnev AYu, Baranov VI, Petrov SYu. [Pseudoexfoliation syndrome as a risk factor for «dry eye» syndrome]. RMJ. Clinical ophthalmology. 2016;17(1):30–34. (in Russian).
- Brzheskiy VV, Egorova GB, Egorov EA. [«Dry eye» syndrome and diseases of the eye surface: clinical course, diagnostics, treatment]. Moscow: GEOTAR-Media; 2016. 464 p. (in Russian).
- Brzheskij VV, Somov EE. [Corneal and conjunctival xerosis]. Saint-Petersburg; 2003. 119 p. (in Russian).
- Egorov EA, Brzheskij VV, Muratova NV. [Undesirable effects of ophthalmo-hypotensive therapy: «dry eye» syndrome]. Glaucoma News. 2009;3:3–5. (in Russian).
- Egorov EA. [Glaucoma. National Guideline]. Moscow: GEOTAR-Media; 2013. 824 p. (in Russian).
- Egorov EA, Astahov JuS, Erichev VP. [Glaucoma. National Guideline]. Moscow: GEOTARMedia; 2015. 456 p. (in Russian).
- Egorov EA, Kuroyedov AV. [Clinical and epidemiological characteristics of glaucoma in CIS and Georgia. Results of multicenter opened retrospective trial (part 1)]. Clin. Ophthalmol. 2011;3:97–100. (in Russian).
- Egorov EA, Kuroyedov AV. [Clinical and epidemiological characteristics of glaucoma in CIS and Georgia. Results of multicenter opened retrospective trial (part 2)]. Clin. Ophthalmol. 2012;1:19–22. (in Russian).
- Avdeev RV, Alexandrov AS, Basinskiy AS, et al. [Risk factors of glaucoma development and progression according to the results of a multicenter study of Russian glaucoma society]. Medical and biological problems. 2012;2(8):57–69. (in Russian).
- Avdeev RV, Alexandrov AS, Basinskiy AS, et al. [The degree of mutual influence and the relationship between morphofunctional characteristics of primary open angle glaucoma and macular degeneration]. Ophthalmology J. 2014;7(1):19–27. (in Russian).
- Avdeev RV, Alexandrov AS, Bakynina NA, et al. [Prediction of the disease duration and the age of patients with different stages of primary open-angle glaucoma]. National J. Glaucoma. 2014;13(2):60–69. (in Russian).
- Abysheva LD, Avdeev RV, Alexandrov AS, et al. [Multicenter study of IOP level in patients with moderate and advanced primary open-angle glaucoma during the treatment]. Ophthalmology J. 2015;8(1):43–60. (in Russian).
- Kuroedov AV, Abysheva LD, Avdeev RV, et al. [The cost-effectiveness ratio study during local hypotensive therapy in patients with advanced primary open angle glaucoma (multicenter study)]. Russian Ophthalmological J. 2015;8(3):10–22. (in Russian).
- Abysheva LD, Avdeev RV, Aleksandrov AS, et al. [Optimum upper level of IOP in patients with advanced primary open angle glaucoma in terms of evidence-based medicine]. RMJ. Clinical Ophthalmology. 2015;8(3):111–123. (in Russian).
- Kuroedov AV, Avdeev RV, Aleksandrov AS, et al. [Primary open-angle glaucoma: at what age of the patient and at what duration of the disease blindness can occur]. Medical and biological problems of life. 2014;2(12):74–84. (in Russian).
- Avdeev RV, Aleksandrov AS, Bakunina NA, et al. [Model of primary open angle glaucoma manifestations and outcomes]. Clinical medicine. 2014;92(12):64–72. (in Russian).
- Avdeev RV, Aleksandrov AS, Basinskii AS, et al. [Multicentre study of morphofunctional status of visual analyzer in simultaneous presence of glaucoma and age-related macular degeneration in one eye with determination of their correlations and connections]. Ophthalmology. Eastern Europe. 2013;4:15–25. (in Russian).
- Abysheva LD, Aleksandrov AS, Arapiev MU. [Optimization of diagnosis and treatment options in primary open-angle glaucoma patients]. National J. Glaucoma. 2016;15(2):19–35. (in Russian).
Стаття надійшла в редакцію 29.06.2017 р.
Рецензія на статтю надійшла в редакцію 03.08.2017 р.