- Автор: Super User
- Категорія: № 2 (07) 2017
- Опубліковано: 17 квітня 2018
- Перегляди: 5300
УДК 617.776−008.6−036−071:616379−008.64−06:616.833
https://doi.org/10.30702/Ophthalmology.2017/07.art2
Бездетко П. А., Ивженко Л. И.
Харьковский национальный медицинский университет, г. Харьков, Украина
Резюме. Дисфункция мейбомиевых желез (ДМЖ) – хроническая диффузная патология мейбомиевых желез, которая обычно характеризуется обструкцией выводных протоков и/или качественным/количественным изменением секреции желез. Причиной ее возникновения может стать нарушение иннервации мейбомиевых желез в результате диабетической полинейропатии (ДПН).
Цель исследования – повысить эффективность диагностики дисфункции мейбомиевых желез у больных с симптоматической А- и В-диабетической полинейропатией.
Материалы и методы исследования. Стандартные методы офтальмологического исследования, тест Ширмера до и через 2 часа после компрессии век, проба Норна, компрессионный тест для оценки выделительной способности мейбомиевых желез и качества их секрета, контактная мейбография с использованием зеленого света, IVAD, OPI тесты. Симптоматическую А (N2A) стадию ДПН зарегистрировали у 31 больного (62 глаза). Симптоматическую В (N2В) стадию ДПН – у 34 больных (68 глаз). В контрольную группу включили 97 человек без сахарного диабета.
Результаты. Тест Ширмера у пациентов с N2А (5,87 мм) и N2В (7,34 мм) стадиями был снижен в 1,7 и 2,2 раза в сравнении с контролем (12,82) (р < 0,001). Проба Норна у больных с N2А (5,54 мм) и N2В (4,22 мм) стадиями ДПН была в 1,7 и 2,3 раза меньше, чем у пациентов без сахарного диабета (9,48 с) (р < 0,001). Показатель OPI теста у больных с сахарным диабетом с N2А- и N2В-стадиями был ниже, чем в группе контроля в 1,6 и 1,7 раза (р < 0,001). Тест Ширмера после компрессии век у пациентов с N2А и N2В был одинаково в 1,6 раза больше, чем до нее (р < 0,05). По данным мейбографии, у пациентов с N2А и N2В площадь, на которой было нарушение функционирования мейбомиевых желез, соответствует 2-й и 3-й степени, а качество секрета соответствовало 2-й степени.
Выводы. У пациентов с N2А-стадией ДПН чаще встречается II (41,9 %) и III (32,3 %) стадии ДМЖ, I стадия была обнаружена у 16,1 %, а IV – у 9,7 %. У пациентов с N2В-стадией ДПН чаще встречается III (47,1 %) стадия ДМЖ, в то время как I стадия была обнаружена у 8,8 %, II – у 26,5 % и IV – у 17,6 %.
Ключевые слова: дисфункция мейбомиевых желез, диабетическая полинейропатия, тест Ширмера, контактная мейбография, секрет мейбомиевых желез.
АКТУАЛЬНОСТЬ
По определению ВОЗ, диабетическая полинейропатия (ДПН) – болезнь, характеризующаяся прогрессирующей гибелью нервных волокон, приводящей к потере чувствительности и развитию язв стопы [5]. Ряд авторов указывают, что развитие ДПН зависит от компенсации углеводного обмена, длительности и типа сахарного диабета (СД): ДПН диагностируется у 7,5–10 % пациентов с впервые выявленным СД 2-го типа [9]. По данным других авторов, ее распространенность при СД 1-го и 2-го типа примерно одинакова и зависит не только от продолжительности СД, но и от эффективности его лечения [5].
При СД часто поражается передний отрезок глаза [1]. В этой связи заслуживает внимания патологическое состояние переднего отрезка глаза – дисфункция мейбомиевых желез (ДМЖ). Это хроническая диффузная патология мейбомиевых желез, которая обычно характеризуется обструкцией выводных протоков и/или качественным/количественным изменением секреции желез. Ее следствием может стать нарушение слезной пленки, симптомы раздражения глаз, клинически выраженное воспаление и заболевания поверхности глаза [6]. Мейбомиевые железы имеют парасимпатическую иннервацию. Мышцы Риолана окружают их выводные протоки и влияют на выработку секрета [7]. Как было отмечено ранее [5], при ДПН поражаются нервные волокна и их отростки в центральной и периферической нервной системе. Логично допустить, что изменения при ДПН могут влиять на структуру и функционирование мейбомиевых желез, способствуя развитию ДМЖ. Данные об этом в литературе отсутствуют.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Повысить эффективность диагностики ДМЖ у больных с симптоматической А- и В-ДПН.
МАТЕРИАЛЫ И МЕТОДЫ
Симптоматическую А-ДПН (N2А-стадию) зарегистрировали у 31 больного (62 глаза). Диагноз был установлен неврологом на основании характерных жалоб и выявленных клинических симптомов этого заболевания без признаков слабости сгибателей стопы (больной мог стоять на пятках). Преобладали «позитивные симптомы» раздражения чувствительных волокон, постепенно растущие нарушения вибрационной, температурной, болевой и тактильной чувствительности. Женщины составили 67,7 % (21 человек), мужчины – 32,3 % (10 человек). Возраст больных колебался от 51 до 67 лет. Продолжительность СД у 52,8 % больных составляла 5–10 лет и у 41,7 % больных – 10–15 лет. Продолжительность СД около 5 лет отмечалась у 2 больных (5,5 %). У большинства пациентов наблюдалась субкомпенсация СД (80,6 %, 25 больных), компенсация была у некоторых больных (12,9 %, 4 больных), декомпенсация – у 2 больных (6,5 %). Преобладало течение средней тяжести (83,9 %, 26 больных), тяжелое течение наблюдалось у 9,8 % (3 больных), легкое – у 6,5 % больных (2 больных). Диабетическая ретинопатия была отмечена у 75,8 % глаз (47 глаз): непролиферативная – у 35,5 % (22 глаза), препролиферативная – у 27,4 % (17 глаз), пролиферативная – у 12,9 % (8 глаз).
Симптоматическую В-ДПН (N2В-стадию) зарегистрировали у 34 больных (68 глаз). Диагноз был установлен неврологом на основании характерных жалоб и выявления клинических симптомов ДПН с признаками слабости сгибателей стопы (больной не мог стоять на пятках). Преобладали симптомы выпадения различных видов чувствительности («негативные симптомы»), при этом количество жалоб пациента парадоксально снижалось. Больше всего больных беспокоило чувство онемения, наиболее выраженное в дистальных отделах конечностей (синдром ватных ног). Женщины составили 50 % (17 человек), мужчины – 50 % (17 человек). Возраст пациентов колебался от 52 до 69 лет. Продолжительность СД у 58,8 % больных составляла 5–10 лет и у 29,4 % больных – 10–15 лет. Продолжительность СД около 5 лет и более 15 лет встречалась с одинаковой частотой – 5,9 % случаев (у 2 больных). У большинства больных наблюдалась субкомпенсация СД (91,2 %, 31 больной), декомпенсация встречалась с частотой 8,8 % (3 больных). Преобладало течение средней тяжести (82,4 %, 28 больных), тяжелое течение обнаружено у 11,8 % (4 человека), легкое – у 5,8 % больных (2 человека). Диабетическая ретинопатия отмечена у 83,8 % глаз больных (56 глаз) с клинической В-стадией: непролиферативная – у 25,4 % (17 глаз), препролиферативная – на 40,4 % (27 глаз), пролиферативная – у 18 % (12 глаз).
Группа контроля состояла из 97 человек (51 женщина, 46 мужчин; 194 глаза) без СД. Это пациенты, обратившиеся для профилактического обследования и подбора очков. Была отобрана группа больных старше 40 лет с отсутствующей глаукомой в анамнезе, у которых значения тонометрического давления не превышали 24 мм рт. ст. В исследование включали только глаза с эмметропией (или с гиперметропией, или миопией слабой степени). Возраст пациентов колебался от 35 до 71 года. Таким образом, по полу, возрасту группы больных были сопоставимы.
Кроме стандартных (визометрии, биомикроскопии, офтальмоскопии) методов офтальмологического исследования проводили тест Ширмера до и через 2 ч после массажа век, пробу Норна, компрессионный тест для оценки выделительной способности и качества секрета мейбомиевых желез, контактную мейбографию с использованием зеленого света, тесты IVAD, OPI.
Для уточнения полученных результатов тест Ширмера проводили также через 2 ч (время восстановления секреции мейбомиевых желез) [3] после массажа век стеклянными палочками. После этой процедуры можно отметить изменения исследуемого показателя, которые свидетельствуют о наличии синдрома сухого глаза или ДМЖ. При синдроме сухого глаза показатель теста Ширмера существенно не отличается от такого же после массажа век (патент Украины на полезную модель № 114141 от 27.02.2017 г.).
Состояние слезной пленки исследовали при помощи пробы Норна. Компрессионный тест для оценки выделительной способности и качества секрета МЖ проводили за щелевой лампой «PS-615» фирмы Topcon путем пальцевой компрессии век на стеклянной палочке. При этом исследовании захватывается одна треть век в центральной части (около 5 мейбомиевых желез) и после небольшой компрессии оценивается функциональная способность желез. В зависимости от количества желез, которые нормально выделяют секрет, определяют степень нарушения выделительной способности желез:
0-я степень или 0 баллов – все железы нормально функционируют;
1-я степень или 1 балл – 3–4 железы функционируют;
2-я степень или 2 балла – 1–2 железы функционируют;
3-я степень или 3 балла – ни одна из желез не выделяет секрет.
Тест позволяет определить минимальное количество желез, необходимых для обеспечения адекватного липидного слоя слезы. Если большинство желез нормально функционируют, то существует низкая вероятность развития синдрома сухого глаза, а если меньше 4, то высокая (Korb, 2005) [8].
Кроме секреторной способности желез, также оценивали качество выделившегося секрета. Для этого исследовали 8 желез в центральной части век и брали средний показатель. Секрет желез оценивали в зависимости от изменений и определяли степень нарушения от 0 до 3, где:
0-я степень или 0 баллов (минимальные изменения секрета) – прозрачный секрет;
1-я степень или 1 балл (легкие изменения секрета) – мутный секрет;
2-я степень или 2 балла (умеренные изменения секрета) – мутный секрет с гранулами;
3-я степень или 3 балла (значительные изменения секрета) – секрет в виде «зубной пасты» [4].
Следует отметить, что OPI (Ocular Protection Index) тест определяли отношением показателей пробы Норна к среднему времени между миганиями. Время засекали с помощью секундомера и проводили исследование 2–3 раза, в качестве результата брали среднее арифметическое из всех полученных. Если значение равно 1, то это значит, что каждое мигание соответствует обновлению слезной пленки. То есть, у кого эти показатели ниже 1, имеют существенные проблемы со слезой [10].
Interval Visual Acuity Decay (IVAD) тест проводили с помощью оптотипов Ландольта. В начале исследования пациентам определяли остроту зрения и просили максимально возможное время не моргать. После чего измеряли остроту зрения перед морганием и время до самого моргания. Метод позволяет обнаружить снижение зрительных функций, связанных с нестабильностью слезной пленки.
Контакная мейбография с использованием зеленого света (патент Украины на полезную модель № 112809 от 26.12.2016 г.), проводилась с помощью диафаноскопа Heine HK – 150-2 multi, освещение менялось на волоконному входе на щелевой лампе TOPCON-PS61E. Фотофиксация проводилась с помощью фотокамеры DeltaOptical PRO 1.3 Мп, установленной вместо окуляра выше названной щелевой лампы. После выворота века, к внешней его поверхности приставляли наконечник диафаноскопа, просвечивали веко зеленым светом и оценивали количество и состояние мейбомиевых желез. Полученные данные оценивались с помощью специальной шкалы. Согласно этой шкале можно оценить степень уменьшения количества МЖ на исследуемой площади и определить степень тяжести поражения мейбомиевых желез, где:
степень 0: ≈ 0 %, если нет изменений на всем протяжении исследуемой области;
степень 1: ≤ на 25 % площади века отмечается уменьшение количества мейбомиевых желез;
степень 2: на 26–50 % площади века отмечается уменьшение количества мейбомиевых желез;
степень 3: на 51–75 % площади века отмечается уменьшение количества мейбомиевых желез;
степень 4: на > 75 % площади века отмечается уменьшение количества мейбомиевых желез.
Для определения стадии тяжести ДМЖ использовалась классификация Международного Совета по ДМЖ 2011 года, которая представлена в таблице 1 [2].

РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
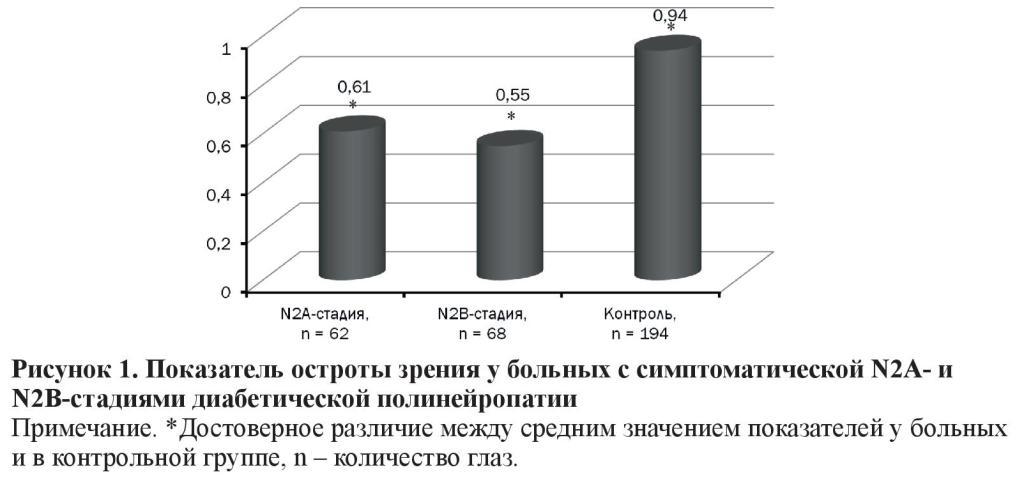
Острота зрения при N2А-стадии (0,61 ± 0,01) и при N2В (0,55 ± 0,01) была ниже (p < 0,001) таковой у пациентов контрольной группы (0,94 ± 0,01) (рисунок 1).
Тест Ширмера у больных со стадиями N2А (7,34 ± 0,37 мм) и N2В (5,87 ± 0,33 мм) был снижен в 1,7 и в 2,2 раза (p < 0,001) в сравнении с контрольной группой (12,82 ± 0,18 мм) (рисунок 2).
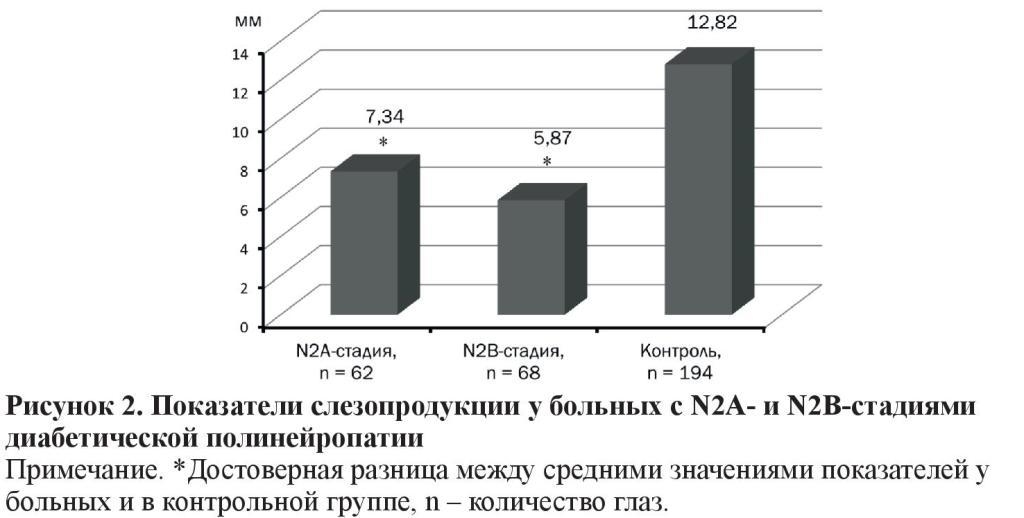
В сравнении с нормой (15 мм) тест Ширмера у пациентов с N2А- и N2В-стадиями был снижен в 2 и в 2,5 раза.
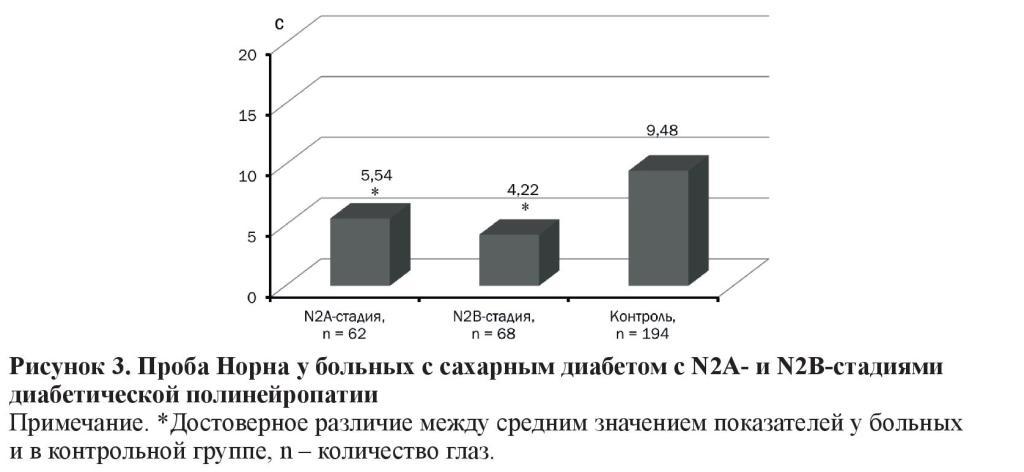
Время разрыва слезной пленки у больных со стадиями N2А (5,54 ± 0,24 с) и N2В (4,22 ± 0,30 с) ДПН было ниже нормы, достоверно не отличалось между группами, но в 1,7 и 2,3 раза (p < 0,001) было меньше, чем в контрольной группе (9,48 ± 0,08 с) (рисунок 3).
Для оценки стабильности слезной пленки всем пациентам проводили IVADтест (таблица 2).
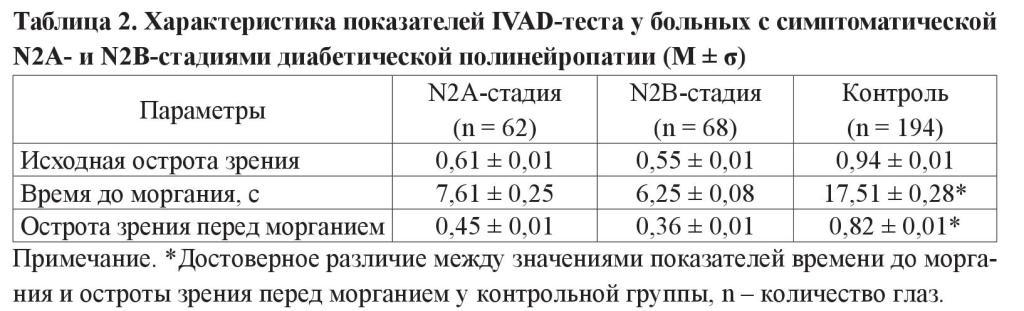
Причем не отмечалось и достоверного различия между исследуемыми параметрами в пределах группы больных с СД без ДПН.
Время до моргания у контрольной группы на 9,9 ± 0,03 с было больше, чем у больных с N2А-стадией и на 11,3 ± 0,2 с больше по сравнению с N2В-стадией ДПН. Острота зрения перед морганием у пациентов группы контроля была больше в 1,8 раза по сравнению с пациентами с N2А-стадией и в 2,3 раза – с N2Встадией (p < 0,001).
Нарушение состояния слезной пленки определяли с помощью OPI-теста:
![]()
У больных с СД со стадиями N2А и N2В показатель OPI был ниже, чем в группе контроля и соответственно ниже нормы. Так, в группе контроля он превышал аналогичный у пациентов с N2А-стадией в 1,6 раза, а у пациентов с N2В-стадией – в 1,7 раза (p < 0,001). Причем не отмечалось достоверного различия между исследуемыми параметрами в пределах группы больных с симптоматической А- и В-ДПН.
Для уточнения теста Ширмера и оценки функционирования липидного слоя мы проводили его до и через 2 ч после массажа век стеклянными палочками (таблица 3).

Результаты теста Ширмера после массажа век у пациентов группы контроля незначительно увеличились (13,47 ± 0,15 мм). При N2А- и N2B-стадии ДПН тест Ширмера после компрессии был в 1,6 раза больше, чем до нее (р < 0,05).
При проведении мейбографии у больных с симптоматической А- и В-ДПН, по количеству функционирующих мейбомиевых желез и площади, на которой они располагались, были определены 2-й и 3-й классы:

У больных с симптоматической А- и В-ДПН отмечалось достоверное снижение количества функционирующих желез относительно контрольной группы.
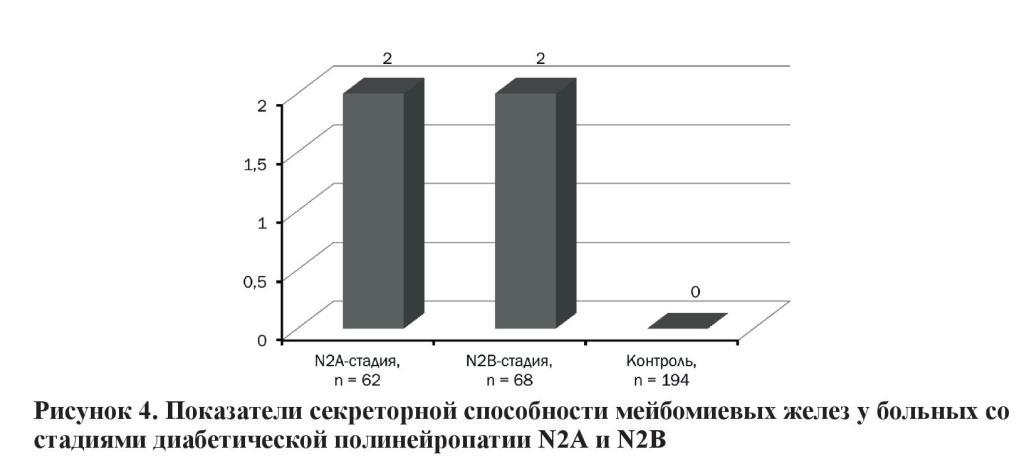
Секреторная способность желез при стадиях N2А и N2В соответствовала в среднем 2 степени по шкале Pflugfilder, что свидетельствует об умеренном уменьшении количества функционирующих желез по сравнению с нормой и достоверно отличалась от такой у пациентов контрольной группы (0 степень), что показано на рисунке 4.
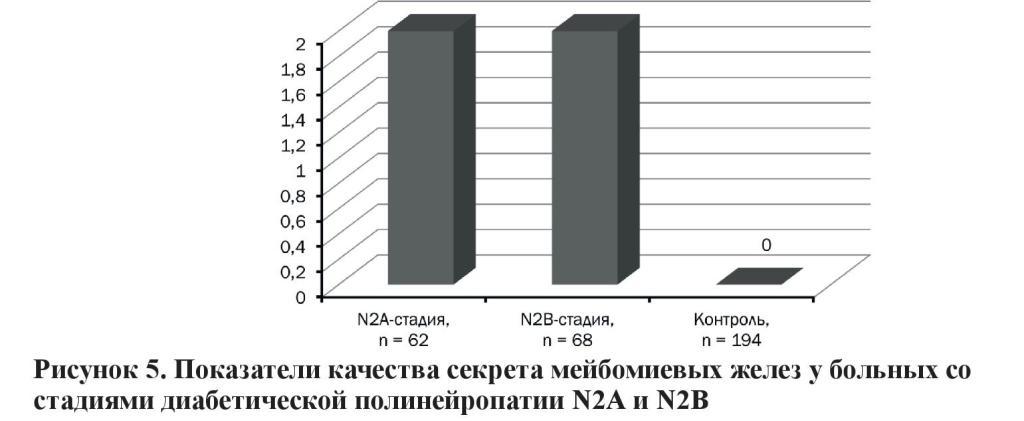
В группе пациентов со стадиями ДПН N2А и N2В имеются умеренные изменения секрета – 2 степень. В контрольной группе изменений качества секрета практически не было (рисунок 5).
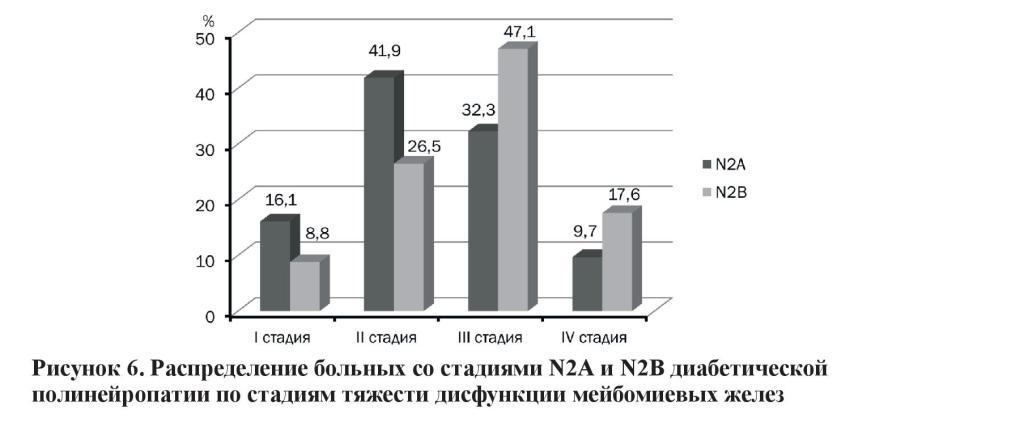
Таким образом, на основании полученных результатов, выяснилось, что у большинства пациентов с N2А-стадией чаще встречается II (41,9 %) и III (32,3 %) стадии ДМЖ, I стадия была обнаружена у 16,1 %, а IV – у 9,7 %. У пациентов с N2Встадией чаще встречается III (47,1 %) стадия ДМЖ, в то время как I была обнаружена у 8,8 %, II – у 26,5 % и IV – у 17,6 % (рисунок 6).
ВЫВОДЫ
У больных с симптоматической А- и В-ДПН отмечались клинические изменения структуры и функционального состояния мейбомиевых желез по сравнению с пациентами группы контроля:
– суммарная слезопродукция у пациентов со стадиями N2А и N2В (5,87 и 7,34 мм) была снижена в сравнении с таким же показателем в контрольной группе (12,82; p < 0,001) и достоверно отличалась от нормы в 1,7 и в 2,2 раза соответственно;
– проба Норна у пациентов со стадиями N2А и N2В (5,54 и 4,22 с) была в 1,7 и в 2,3 раза меньше по сравнению с пациентами без СД (9,48 с; p < 0,001);
– показатели IVAD-теста отличались у пациентов без СД. Время до моргания в группе контроля на 9,9 ± 0,03 с было больше, чем у больных с N2А-стадией и на 11,3 ± 0,2 с больше, чем у больных с N2В-стадией ДПН. Острота зрения перед морганием у пациентов группы контроля была больше в 1,8 раза, чем у пациентов со стадией N2А, и в 2,3 раза – со стадией N2В (p < 0,001);
– показатель OPI у больных со стадиями N2А и N2В был ниже, чем в группе контроля, и соответственно ниже нормы. Так, у пациентов контрольной группы он превышал аналогичный у пациентов с N2А-стадией в 1,6 раза, а у пациентов с N2В-стадией – в 1,7 раза (p < 0,001);
– результаты теста Ширмера после массажа век в группе контроля незначительно изменились (13,45 ± 0,15 мм). У пациентов со стадиями N2А и N2В он после компрессии был одинаково в 1,6 раза больше, чем до нее (p < 0,05);
– согласно результатам мейбографии, у пациентов со стадиями N2А и N2В площадь, на которой имеются нарушения функционирования мейбомиевых желез, соответствует классу 2 и 3. Секреторная способность желез при стадиях N2А и N2В соответствовала в среднем 2 степени и достоверно отличалась от такой у пациентов контрольной группы (0 степень);
– в группе пациентов со стадиями N2А и N2В ДПН отмечались умеренные изменения секрета – 2 степень. В контрольной группе изменений качества секрета практически не было (0 степень);
– у большинства пациентов с N2А-стадией чаще встречается II (41,9 %) и III (32,3 %) стадии ДМЖ, I стадия была обнаружена у 16,1 %, а IV – у 9,7 %. У пациентов с N2В-стадией чаще встречается III (47,1 %) стадия ДМЖ, в то время как I была обнаружена у 8,8 %, II – у 26,5 % и IV – у 17,6 %.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Можеренков В. П. Глазные проявления сахарного диабета / В. П. Можеренков, Г. Л. Прокофьева, Л. А. Усова // РМЖ «Клиническая Офтальмология». − 2002. − №1. − С. 31.
- Тронько Н. Д. По материалам 42-го конгресса Европейской ассоциации по изучению сахарного диабета / Н. Д. Тронько // Здоров’я України. − 2006. − № 21 (154). − С. 10−15.
- Blackie C. A. Recovery time of an optimally secreting meibomian gland / C. A. Blackie, D. R. Korb // Cornea. − 2009. − Vol. 28. − P. 293–297. doi: 10.1097/ICO.0b013e31818913b4.
- Bron A. J. Meibomian gland disease. Classification and grading of lid changes / Bron A. J., Benjamin L., Snibson G. R. // Eye (Lond). − 1991. − Vol. 5. − P. 395–411. doi: 10.1038/ eye.1991.65.
- Prevalence by staged severity of various types of diabetic neuropathy, retinopathy, and nephropathy in population-based cohort: Rochester Diabetic Neuropathy Study / P. J. Dyck, K. M. Kratz, J. L. Karnes, [et al.] // Neurology. − 1993. − Vol. 43 (4). − P. 817−824.
- Foulks G. N. Meibomian gland dysfunction: A clinical scheme for description, diagnosis, classification and grading / G. N. Foulks, A. J. Bron // Ocul Surf. − 2003. − Vol. 1 (3). − P. 107–126.
- Linton R. G. The meibomian glands: an investigation into the secretion and some aspects and some aspects of the physiology / R. G. Linton, D. H. Curnow, W. J. Riley // Br. J Ophthalmol. − 1961. − Vol. 5 (11). − P. 718−723.
- Evaluation of subjective assessments and objective diagnostic tests for diagnosing tear-film disorders known to cause ocular irritation / S. C. Pflugfelder, S. Tseng, O. Sanabria, [et al.] // Cornea. − 1998. − Vol. 17. − P. 38−56.
- Prevalence of diabetic neuropathy with somatic symptoms: a door-to-door survey in two Sicilian municipalities / G. Savettieri, W. A. Rocca, G. Salemi, [et al.] // Neurology. −1993. − Vol. 43 (6). − P. 1115−1120.
- The international workshop on meibomian gland dysfunction: executive summary / K. K. Nichols, G. N. Foulks, A. J. Bron, [et al.] // Invest Ophthalmol Vis Sci. − 2011. − Vol. 52 (4). − P. 1922−1929.
REFERENCES
- Mozherencov VP, Prokofyeva GL, Usova LA. [Eye manifestations of diabetes mellitus]. RMZh “Klinicheskaya Oftalmologiya”. 2002;1:31. (in Russian).
- Tronko ND. [According to the materials of the 42nd Congress of the European Association for the Study of Diabetes]. Zdorovia Ukrainy. 2006;21(154):10−15. (in Russian).
- Blackie CA, Korb DR. Recovery time of an optimally secreting meibomian gland. Cornea. 2009;28:293–7. doi: 10.1097/ICO.0b013e31818913b4
- Bron AJ, Benjamin L, Snibson GR. Meibomian gland disease. Classification and grading of lid changes. Eye (Lond). 1991;5:395–411. doi: 10.1038/eye.1991.65
- Dyck PJ, Kratz KM, Karnes JL, Litchy WJ, Klein R, Pach JM, Wilson DM, O’Brien PC, Melton LJ 3rd, Service FJ. Prevalence by staged severity of various types of diabetic neuropathy, retinopathy, and nephropathy in population-based cohort: Rochester Diabetic Neuropathy Study. Neurology. 1993;43(4):817−24.
- Foulks GN, Bron AJ. Meibomian gland dysfunction: A clinical scheme for description, diagnosis, classification and grading. Ocul Surf. 2003;1(3):107–26.
- Linton RG, Curnow DH, Riley WJ. The meibomian glands: an investigation into the secretion and some aspects and some aspects of the physiology. Br J Ophthalmol. 1961 Nov; 45(11):718−23.
- Pflugfelder SC, Tseng S, Sanabria O, Kell H, Garcia CG, Felix C, Feuer W, Reis BL. Evaluation of subjective assessments and objective diagnostic tests for diagnosing tear-film disorders known to cause ocular irritation. Cornea. 1998;17:38−56.
- Savettieri G, Rocca WA, Salemi G, Meneghini F, Grigoletto F, Morgante L, Reggio A, Costa V, Coraci MA, Di Perri R. Prevalence of diabetic neuropathy with somatic symptoms: a door-to-door survey in two Sicilian municipalities. Neurology. 1993;43(6):1115−20.
- Nichols KK, Foulks GN, Bron AJ, et al. The international workshop on meibomian gland dysfunction: executive summary. Invest Ophthalmol Vis Sci. 2011 Mar 30;52(4):1922−9.
Стаття надійшла в редакцію 04.04.2017 р.
Рецензія на статтю надійшла в редакцію 02.05.2017 р.