- Автор: Super User
- Категорія: №3 (05) 2016
- Опубліковано: 20 квітня 2018
- Перегляди: 5930
УДК 617.713–036–073.178–08–035
Шаргородская И. В.
Национальная медицинская академия последипломного образования им. П. Л. Шупика, г. Киев, Украина
Резюме. Накопленные в последние десятилетия знания о патогенезе наиболее актуальных и социально значимых патологий глаза, таких как прогрессирующая близорукость, кератоконус и другие, свидетельствуют о значительном участии биомеханических факторов в формировании и развитии дистрофических процессов при этих заболеваниях. В статье представлен сравнительный анализ измерения биомеханических показателей роговицы у пациентов с кератоконусом при использовании различных методов. Обследовано 44 пациента (88 глаз) с кератоконусом и эмметропической рефракцией. Отмечены значительные преимущества использования разработанного нового способа и прибора для оценки ригидности роговицы in vivo по сравнению с общеизвестным методом оценки, анализатором глазного ответа Ocular Response Analyzer (ORA), эластотонометрией, модулем для мониторинга эктазии Белина/Амброзио (BAD) Шеймпфлюг-камеры Oculus Pentacam, который позволяет не только выявить наличие биомеханических нарушений роговицы при кератоконусе, но и дифференцировать их характер. Разработан коэффициент ригидности роговицы (KER). Повышение этого показателя выше (+)6,4 % может служить критерием начала прогрессирования кератоконуса.
Ключевые слова: кератоконус, роговица, биомеханические свойства, коэффициент ригидности роговицы, эластотонометрия, ORA, Oculus Pentacam.
Последние десятилетия ознаменованы интенсивной разработкой технологии индивидуальной оценки биомеханических свойств тканей глаза. На сегодняшний день [10, 17, 27, 28, 30, 34] описано ряд методов и несколько различных подходов к решению данной проблемы, свидетельствующих о том, что для диагностики биомеханических свойств роговицы используются две основные методики: анализатор глазного ответа Ocular Response Analyzer (ORA) и кератотопография, выполненная с помощью Orbscan II, Oculus Pentacam, Oculazer и др. Однако у каждого из них есть свои ограничения. Так, например, анализ с помощью ORA позволяет определить измерение роговичного гистерезиса (СН), который, по мнению авторов [10, 17, 25, 27, 28, 30, 31], является ключевой величиной диагностики кератоконуса. При этом не следует забывать, что измерение показателей происходит только в самом центре роговицы. Вторая группа диагностических приборов позволяет обнаружить разницу в морфологических особенностях нормальной роговицы и на глазу с кератоконусом, что, согласно данным разработчиков, выступает главным прогностическим критерием диагностики. Тем не менее, несмотря на кажущиеся преимущества обеих методик, остается еще целый ряд противоречивых положений, доказанных ограничений, нерешенных вопросов и недостатков представленных методов [10, 30, 34].
Кроме того, в последние годы отмечается четкая тенденция к увеличению удельного веса инвалидов с патологией роговицы (на 4 %), которая занимает стабильное седьмое место в структуре инвалидности по зрению в Украине [9, 15]. Высокая инвалидность, обусловленная быстрым прогрессированием, ранним развитием осложнений и отсутствием законодательной базы в государстве по вопросам трансплантологии при заболеваниях роговицы, ставит борьбу с ней в один ряд с важнейшими социальными задачами, поставленными перед офтальмологами, и требует широкого применения современных методов профилактики, диагностики и лечения [9, 15]. В связи с этим особенно сложными и неоднозначными в диагностике, прогнозе заболевания, выборе адекватного и рационального метода лечения являются диагностика и лечение кератоконуса.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Осуществить сравнительный анализ измерения биомеханических показателей роговицы у пациентов с кератоконусом при использовании различных методов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследовано 44 пациента (88 глаз). Основную группу составили 24 пациента (48 глаз) с кератоконусом. В группу сравнения включили 20 пациентов (40 глаз) с эмметропической рефракцией, острота зрения которых была выше 0,5. Обе группы были сопоставимы по возрасту и полу. Пациенты основной группы и группы сравнения проходили комплексное офтальмологическое обследование на клинической базе кафедры офтальмологии Национальной медицинской академии последипломного образования имени П. Л. Шупика КГКОБ «Центр микрохирургии глаза» и были полностью осведомлены о характере исследования (Протокол решения этического комитета НМАПО имени П. Л. Шупика КЕ № 3 (71) от 14.03.2011 г.). Необходимо отметить, что из 48 глаз основной группы у всех пациентов (100 %) отмечалась миопическая рефракция. При этом острота зрения выше 0,5 была зафиксирована у 33,3 % пациентов основной группы, у 50,0 % она была в диапазоне от 0,1 до 0,4 и в 16,7 % случаев острота зрения была ниже 0,1. В целом по основной группе пациентов исходный уровень ВГД был равен 10,31 ± 1,94 мм рт. ст. Тогда как у пациентов группы сравнения исходное среднее значение уровня ВГД соответствовало 13,46 ± 2,15 мм рт. ст. При первичном скрининге пациентов особое внимание обращали на наличие (отсутствие) сопутствующей патологии. Дистрофия сетчатки была выявлена в 8,3 % случаев (9 глаз) пациентов основной группы. У пациентов группы сравнения отсутствовала сопутствующая офтальмологическая патология.
Все глаза пациентов основной группы на основании биомикроскопических признаков роговицы [6, 19, 24] (согласно классификации Amsler M., дополненной Киваевым А. А. и соавторами) [2, 6, 19] были классифицированы по стадиям кератоконуса следующим образом: 14 глаз (29,17 %) с кератоконусом I стадии; 12 глаз (25,0 %) с кератоконусом II стадии; 12 глаз (25,0 %) с кератоконусом III стадии и на 10 глазах (20,83 %) была диагностирована IV стадия заболевания.
Для оценки чувствительности, специфичности, достоверности и точности разработанного нами нового способа оценки биомеханических показателей роговицы in vivo [12] у пациентов с кератоконусом был проведен сравнительный анализ между измерениями биомеханических показателей, вычисленных с использованием эластотонометрии по Филатову – Кальфа в классическом варианте [3], измерениями биомеханических показателей роговицы, вычисленных с использованием общеизвестного метода оценки с помощью ORA, измерениями показателей роговицы с использованием модуля для мониторинга эктазии Белина/Амброзио (BAD), вычисленных на Шеймпфлюг-камере Oculus Pentacam, и измерениями, полученными путем использования предложенного нами способа и прибора для оценки ригидности роговицы in vivo [12, 13] у одних и тех же пациентов с кератоконусом основной группы. В качестве сравнения были взяты измерения показателей роговицы пациентов с эмметропической рефракцией (группа сравнения).
Оценка ригидности роговой оболочки глаза in vivo [12] осуществлялась следующим образом: исходно проводили базисные исследования кератотопографических характеристик на Шеймпфлюг-камере Oculus Pentacam без нагрузки по стандартной методике. Затем повторно в условиях искусственного повышения ВГД, которое реализовывали с помощью прибора для определения ригидности роговой оболочки глаза in vivo (патент Украины на изобретение № 85810 от 25.02.2009 г.) [12, 13], создающего равномерную дозированную двухминутную компрессию глазного яблока в 30 грамм, проводили измерения тех же показателей с использованием стандартных программ Шеймпфлюг-камеры Oculus Pentacam. Полученные данные исследования фиксировали в статистической карте обследования пациента. Проводили расчет показателя ∆СЭ (∆СЭ = СЭ2 – СЭ1, где СЭ2 – сферический эквивалент во время нагрузки, СЭ1 – сферический эквивалент в исходном состоянии) и коэффициента ригидности роговицы (KER). Для оценки изменений биомеханических свойств роговицы in vivo была разработана формула, описывающая коэффициент ригидности роговицы [18]. Полученные результаты обрабатывали статистически с использованием программы Microsoft Offce Excel 2010.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Полученные результаты исследования поданы в таблицах 1–2 и на рисунке 1.
Согласно результатам (таблица 1), условия нагрузки и применение нового способа оценки ригидности роговицы in vivo позволяют выявить значительную достоверную разницу между биомеханическими свойствами роговицы эмметропических глаз и глаз пациентов с кератоконусом, характеризующуюся ослаблением прочностных свойств роговицы, увеличением ∆СЭ и KER.
Отмечалась достаточная вариабельность деформации, а также прямая сильная корреляция между стадией кератоконуса и уровнем деформации (чем выше стадия кератоконуса, тем больше деформация). Сила корреляции между KER и стадией кератоконуса соответствовала r = 0,95 (по Пирсону, р < 0,05). Коэффициент корреляции по Пирсону между ∆СЭ и стадией кератоконуса был равен r = 0,93 (р < 0,05).
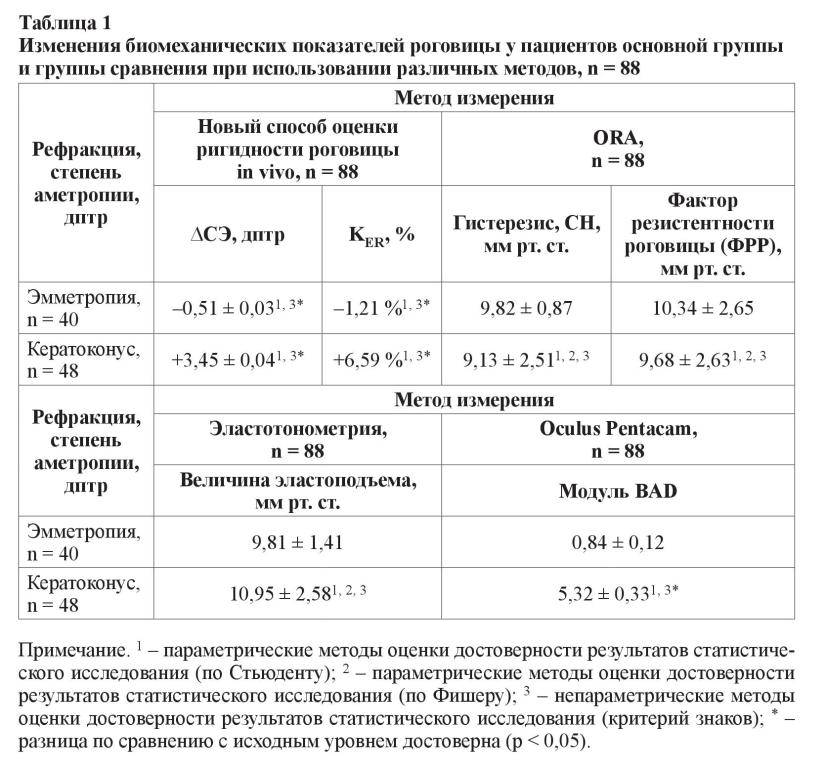
Однако исследование показателей роговицы у этих же пациентов на анализаторе биомеханических свойств глаза (ORA) позволило констатировать статистически незначимую тенденцию к изменению показателей гистерезиса (СН) и фактора резистентности роговицы (ФРР) в сторону уменьшения при кератоконусе по сравнению со значениями этих показателей на глазах с эмметропией (таблица 1). Так, средние значения показателей СН и ФРР при эмметропии были равны 9,82 ± 0,87 мм рт. ст. и 10,34 ± 2,65 мм рт. ст. Тогда как при кератоконусе среднее значение СН было несколько ниже, чем при эмметропии, 9,13 ± 2,51 мм рт. ст., его изменения были статистически незначимыми и не коррелировали со стадией кератоконуса (r = (–)0,08 по Пирсону; р > 0,05). Отличие средних значений показателя ФРР на глазах с кератоконусом было также статистически незначимым по сравнению с эмметропическими глазами (9,68 ± 2,63 мм рт. ст.) и не зависело от стадии кератоконуса (r = 0,13; р > 0,05).
В то же время обследование этих же пациентов с помощью эластотонометрии по Филатову – Кальфа в классическом варианте (таблица 1) не выявило статистически значимых различий между формой и размахом эластокривых между эмметропами и пациентами с кератоконусом. Как следует из таблицы 1, средний показатель эластоподъема при эмметропии был равным 9,81 ± 1,41 мм рт. ст., тогда как у пациентов с кератоконусом его значение соответствовало 10,95 ± 2,58 мм рт. ст. и не коррелировало со стадией кератоконуса (r = 0,17; р > 0,05). Характер эластокривых также не отличался на глазах у эмметропов и пациентов с кератоконусом.
Кроме того, следует обратить внимание на статистически значимое различие показателей, определяемых с помощью модуля для мониторинга эктазии Белина/ Амброзио (BAD), измеренных на Шеймпфлюг-камере Oculus Pentacam на глазах эмметропов и пациентов с кератоконусом (таблица 1). Анализ результатов показал, что у пациентов с эмметропической рефракцией их значения не превышали 1,5 и в среднем по группе были на уровне 0,84 ± 0,12. У пациентов с кератоконусом их значения в среднем по основной группе соответствовали 5,32 ± 0,33 и коррелировали со стадией кератоконуса (r = 0,91; р < 0,05).
В ходе исследования мы также анализировали влияние исходного уровня ВГД и биометрических характеристик глаз (таких как наименьшая толщина роговицы, рефракция роговицы в центре, радиус кривизны роговицы в крутом меридиане, расстояние от вершины конуса до центра роговицы, элевация задней поверхности роговицы, разница между оптической силой верхушки и периферии роговицы) пациентов с кератоконусом (основная группа) на вычисляемые нами биомеханические показатели, измеренные различными методами.
При статистическом корреляционном анализе была получена статистически достоверная корреляция высокой силы с уровнем ВГД для корнеального гистерезиса и фактора резистентности роговицы. Коэффициент корреляции Пирсона между СН и уровнем ВГД был равен r = (–)0,87 (р < 0,05), для ФРР составил r = 0,91 (р < 0,05).
Помимо этого, была определена прямая корреляция слабой степени для величины эластоподъема и показателей дисплея BAD с уровнем ВГД. Сила корреляции величины эластоподъема с уровнем ВГД составила r = 0,39 (р < 0,05). Корреляция показателей BAD с уровнем ВГД соответствовала r = 0,36 (р < 0,05) по Пирсону.
Следует отметить отсутствие зависимости измеряемых нами биомеханических показателей ∆СЭ и KER от уровня ВГД у пациентов с кератоконусом. Сила корреляции по Пирсону для этих показателей составила r1 = 0,11 и r2 = 0,09 соответственно (р < 0,05).
При исследовании зависимости биомеханических показателей от наименьшей толщины роговицы выявлена обратная связь слабой силы между наименьшей толщиной роговицы и ∆СЭ (r = (–)0,49; р < 0,05), а также между KER и наименьшей толщиной роговицы (r = (–)0,52; р < 0,05).
В то же время корреляция величины эластоподъема с наименьшей толщиной роговицы на этих же глазах была равна r = (–)0,12 (р < 0,05). Зависимость показателя СН от наименьшей толщины роговицы была значительно выше, чем величины эластоподъема (r = (–)0,72 по Пирсону; р < 0,05). Также была отмечена зависимость показателя ФРР от наименьшей толщины роговицы (r = 0,87 по Пирсону; р < 0,05). Обратная сильная корреляция отмечена между показателями BAD и наименьшей толщиной роговицы (r = (–)0,75 по Пирсону; р < 0,05).
Кроме того, результаты исследований демонстрировали отсутствие влияния рефракции роговицы в центре, радиуса кривизны роговицы в «крутом» меридиане, расстояния от вершины конуса до центра роговицы, разницы между оптической силой верхушки и периферии роговицы и элевации задней поверхности роговицы на величину эластоподъема при кератоконусе. Коэффициенты корреляции Пирсона для этих показателей были равны: r1 = 0,21, r2 = (–)0,28, r3 = 0,18, r4 = 0,23 и r5 = 0,29 соответственно (р < 0,05).
Была отмечена обратная слабая зависимость величины СН и ФРР от показателя рефракции роговицы в центре (r1 = (–)0,48; r2 = (–)0,53; р < 0,05), прямая слабая зависимость между СН, ФРР и значениями элевации задней поверхности роговицы (r1 = 0,14; r2 = 0,25; р < 0,05) и прямая слабая зависимость результатов СН и ФРР от расстояния от вершины конуса до центра роговицы (r1 = 0,27 и r2 = 0,34; р < 0,05). Отсутствовала зависимость между показателями СН, ФРР и радиусом кривизны роговицы в «крутом» меридиане (r1 = (–)0,14; r2 = 0,09; р < 0,05), а также между СН, ФРР и разницей между оптической силой верхушки и периферии роговицы (r1 = 0,15; r2 = 0,07; р < 0,05).
Что же касается зависимости измерения биомеханических характеристик: ∆СЭ, K ER и показателей модуля для мониторинга эктазии Белина/Амброзио от биометрических показателей роговицы, обращает на себя внимание факт схожести сильных корреляционных связей между этими показателями при применении обеих методик.
Отмечена прямая сильная корреляции между радиусом кривизны роговицы в «крутом» меридиане и показателями ∆СЭ, KER и BAD. Коэффициент корреляции Пирсона для них составил r1 = 0,79, r2 = 0,85 и r3 = 0,68 соответственно (р < 0,05). Определена сильная зависимость показателей ∆СЭ, KER и BAD от расстояния от вершины конуса до центра роговицы (r1 = 0,81, r2 = 0,89 и r3 = 0,73; р < 0,05). Прослеживалась прямая сильная корреляция между показателями ∆СЭ, KER, BAD и разницей между оптической силой верхушки и периферии роговицы (r1 = 0,86, r2 = 0,78 и r3 = 0,91 соответственно; р < 0,05).
Наибольшая прямая сильная корреляция была зафиксирована нами между элевациями задней поверхности роговицы и показателями ∆СЭ, KER и BAD. Коэффициент корреляции Пирсона для этих показателей был равен r1 = 0,91, r2 = 0,93 и r3 = 0,95 соответственно (р < 0,05).
Полученные результаты свидетельствуют о том, что высокочувствительным показателем изменений биомеханических свойств роговицы при кератоконусе является коэффициент ригидности роговицы (KER), при этом данный показатель в большей степени зависит от элевации задней поверхности роговицы, расстояния от вершины конуса до центра роговицы и радиуса кривизны роговицы в «крутом» меридиане. Отмечено, что корреляционные связи между показателем KER и биометрическими показателями роговицы перекликаются с результатами корреляционного анализа между BAD и теми же показателями.
В то же время в результате нашего исследования выявлено, что показатели СН и ФРР, измеренные с помощью ORA, являются «малоэффективными» показателями определения биомеханических свойств роговицы при кератоконусе, поскольку их значения в большой степени зависят от уровня ВГД, центральной толщины роговицы, в меньшей мере – от рефракции роговицы в центре и практически не зависят от величины радиуса роговицы в «крутом» меридиане, расстояния от вершины конуса до центра роговицы, элевации задней поверхности роговицы и индекса I-S (разницы между оптической силой верхушки и периферии роговицы). Причем в ряде случаев показатели СН и ФРР демонстрировали ложные значения, несоответствующие клинической картине заболевания, особенно при далеко зашедших стадиях кератоконуса.
Что же касается величины эластоподъема, отмечена слабая корреляционная зависимость между его уровнем, ВГД и всеми определяемыми биометрическими показателями на глазах с кератоконусом.
Следует отметить, что для выявления факторов, связанных с риском прогрессирования кератоконуса, нами были построены таблицы сопряженности и использован метод построения и анализа логистических моделей регрессии. В качестве факторных признаков анализ проводился для следующих показателей: уровней коэффициента ригидности роговицы, величины эластоподъема, корнеального гистерезиса, фактора резистентности роговицы и показателей модуля для мониторинга эктазии Белина/Амброзио. Модель строилась на основании результатов исследования 48 глаз пациентов основной группы. Для выявления признаков (факторов), в наибольшей степени связанных с риском прогрессирования кератоконуса, был использован метод пошагового исключения (порог включения переменной р = 0,05, порог исключения выбран р = 0,1). В результате проведения анализа был выделен один значимый признак – коэффициент ригидности роговицы (KER), который с наиболее высокой точностью позволял прогнозировать риск прогрессирования кератоконуса.
Критическое значение (Crit) уровня KER у пациентов с кератоконусом, соответствующее максимальному значению показателя индекса Youden, было равным (+)6,4 % (Crit = (+)6,4 %). При выбранном критическом значении теста его чувствительность составила 93,8 %, специфичность – 97,5 % и точность – 95,65 %. Таким образом, повышение риска начала прогрессирования заболевания у пациентов с кератоконусом связано с уровнем коэффициента ригидности роговицы, превышающим (+)6,4 %.
Для сравнения мы провели анализ показателей чувствительности, специфичности и точности методов эластотонометрии, определения корнеального гистерезиса на ORA, показателей модуля для мониторинга эктазии Белина/Амброзио, вычисляемых с помощью Oculus Pentacam, а также предложенного нами нового способа оценки биомеханических показателей роговицы in vivo и коэффициента ригидности роговицы. Результаты, демонстрирующие проведенный корреляционный анализ между всеми факторными признаками, приведен в таблице 2.
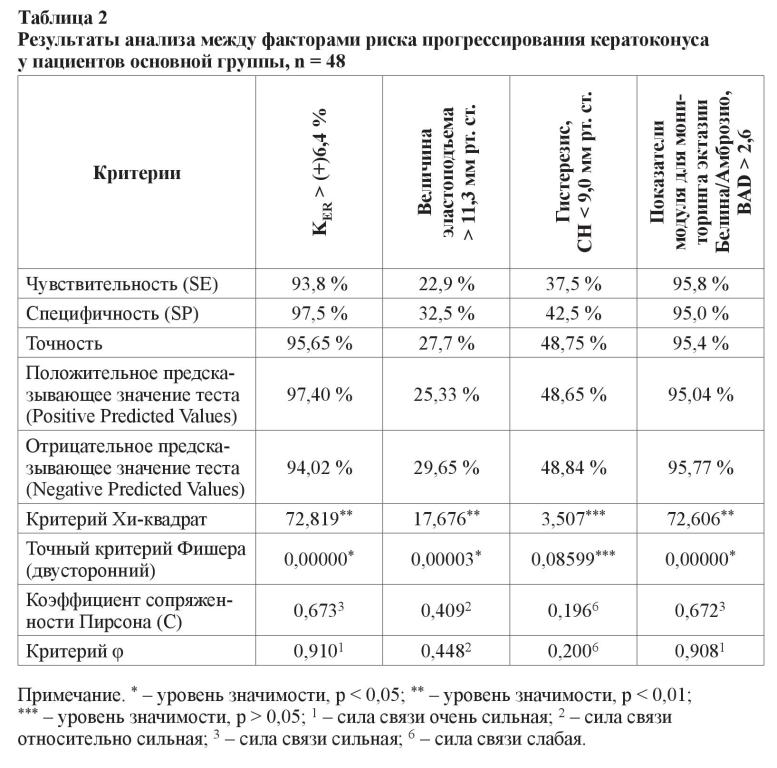
Анализируя результаты, приведенные в таблице 2, необходимо отметить, что уровни корреляционной связи между риском прогрессирования кератоконуса и показателями модуля для мониторинга эктазии Белина/Амброзио (BAD), которые определялись с помощью Шеймпфлюг-камеры Oculus Pentacam, были статистически достоверны. Чувствительность BAD превышала KER и была равна 95,8 %, однако по специфичности и точности показатели этого модуля несколько уступали значениям KER и соответствовали только 95,0 % и 95,4 % (р < 0,01).
Обращает на себя внимание также следующий факт. Уровни корреляционной связи между риском прогрессирования кератоконуса и изменением показателя корнеального гистерезиса, который вычислялся с помощью ORA, были статистически недостоверны (p > 0,05). Чувствительность CH составила 37,5 %, специфичность – 42,5 % и точность – 48,75 % (таблица 2). Кроме того, результаты анализа по эластотонометрии и вычисления величины эластоподъема отметили очень низкую чувствительность (22,9 %), специфичность (32,5 %) и точность (27,7 %) данной методики в плане диагностики рисков прогрессирования кератоконуса (р < 0,01) (таблица 2).
Проанализировав результаты, были построены ROC-кривые теста прогнозирования риска прогрессирования кератоконуса для трех факторных признаков: коэффициента ригидности роговицы, величины модуля BAD и корнеального гистерезиса.
Затем нами был использован метод сравнения ROC-кривых всех трех моделей, где Model 0 – коэффициент ригидности роговицы, Model 1 – величина модуля BAD и Model 2 – величина корнеального гистерезиса. На рисунке 1 приведены кривые характеристики этого теста.
При проведении анализа установлено (рисунок 1), что площадь под ROC-кривой для Model 0 составила AUC0 = 0,94 ± 0,03, для Model 1 – AUC1 = 0,96 ± 0,03, для Model 2 – AUC2 =0,39 ± 0,05. При сравнении ROC-кривых отмечалось статистически значимое различие площадей под ними в пользу Model 0 и Model 1 (p < 0,05) по сравнению с Model 2, которое отражало высокое качество диагностических тестов. Статистически значимого различия площадей под кривыми для Model 0 и Model 1 не выявлено (p > 0,05).
Таким образом, полученные нами результаты указывали на высокую значимость выделенного факторного признака, коэффициента ригидности роговицы выше (+)6,4 % для прогнозирования риска прогрессирования кератоконуса, специфичность и точность которого была выше, чем значения показателей модуля для мониторинга эктазии Белина/Амброзио (BAD). Критерии оценки значимости риска прогрессирования кератоконуса в зависимости от повышения коэффициента ригидности роговицы KER > (+)6,4 % были достоверны (р < 0,01), кроме того, отмечалась сильная связь между фактором и исходом, коэффициент сопряженности Пирсона был равен С = 0,673, критерий φ = 0,910 (таблица 2).
Наши исследования продемонстрировали, что в условиях искусственно повышенного внутриглазного давления использование предложенного нами способа и прибора для оценки ригидности роговицы in vivo [12, 13] позволяет не только выявить наличие биомеханических нарушений роговицы глаз пациентов с кератоконусом по сравнению с контрольными эмметропическими пациентами, но и дифференцировать их различный характер. Тогда как применение общеизвестных методов оценки: эластотонометрии и анализатора биомеханических свойств глаза (ORA), у одних и тех же пациентов позволило лишь констатировать наличие некоторых тенденций к изменению данных показателей, которые были статистически не значимы и не позволяли дифференцировать различный характер этих изменений. Кроме того, в ряде случаев показатели СН и ФРР роговицы демонстрировали ложные значения, несоответствующие клинической картине заболевания, особенно при далеко зашедших стадиях кератоконуса. Тогда как коэффициент ригидности роговицы во всех изучаемых случаях показывал статистически достоверные результаты, которые согласовывались с клиническим течением процесса на этих глазах.
Накопленные за последние десятилетия знания о патогенезе наиболее актуальных и социально значимых патологий глаза, таких как прогрессирующая близорукость, кератоконус и другие, свидетельствуют о значительном участии биомеханических факторов в формировании и развитии дистрофических процессов при этих заболеваниях [7, 8, 14, 21, 22]. Задачи мировых клинических исследований последних лет направлены на создание биомеханических моделей этих заболеваний, в основе которых лежит представление о патологии фиброзной оболочки глаза как о факторе, определяющем их возникновение, развитие и прогрессирование. Таким образом, именно применение идей и методов биомеханики для решения практических задач современной офтальмологии является тем эффективным инструментом, который позволит разработать современные, патогенетически обоснованные методы диагностики и лечения, успешно решить вопросы профилактики и снижения уровня инвалидности вследствие заболеваний органа зрения [8].
Многие ученые, основываясь на создании адекватной механико-математической модели глаза, отдали большую часть своей жизни для разработки объективного и точного прижизненного метода определения биомеханических характеристик склеральной оболочки глаза и роговицы. Было предложено многообразие возможных подходов к построению такой модели [2, 10, 27].
Так, некоторые авторы [1, 2, 10, 29] проводили биомеханическое моделирование на основе тщательного анализа кривых зависимости напряжение – деформация, полученных для образцов изолированной нормальной и миопической склеры. Данный критерий лег в основу разработки устройства для исследования биомеханических свойств роговицы и склеральной оболочки глаза (офтальмомеханографа), который давал возможность получать диаграммы указанного типа. Устройство позволяло осуществлять постепенную локальную циклическую нагрузку с одновременной высокоточной регистрацией смещения исследуемого участка [1, 2, 10, 29]. Данное устройство позволяло объективно оценивать биомеханический статус корнеосклеральной оболочки глаза и с достаточной степенью точности прогнозировать дальнейшее развитие миопического процесса [1, 2, 10, 29]. Однако главным недостатком для использования этого метода выступала громоздкая конструкция прибора, сложность в воспроизведении разными исследователями, оторванность от системы глаз – орбита и отсутствие возможности использования современных регистрационных систем, которые ограничивали широкое внедрение данной методики.
Еще одной попыткой касательно возможностей оценки биомеханических свойств склеры стала разработка метода определения скорости распространения в склере акустических поверхностных волн [10, 20]. Автором была обнаружена прямая корреляция между акустическими свойствами склеры и тарзальной области век [10, 20]. К сожалению, выделить показатель, характеризующий свойства миопической склеры, автору не удалось.
Также на основе ультразвукового сканирования была разработана другая методика определения акустической плотности склеры, которая оценивалась, используя амплитуду затухания эхосигнала, отраженного от склеральной капсулы глаза [2, 10, 11]. Проведенные исследования у пациентов с прогрессирующей близорукостью показали высокую информативность метода, который позволял получить достоверные различия акустической плотности склеры в норме, при миопии средней и высокой степени, а также до и после склероукрепляющих операций. Кроме того, анализируя результаты данных исследований, была выявлена высокая информативность и чувствительность метода компьютерной томографии орбиты для объективной оценки свойств склеры [10, 16]. Отмечено снижение рентгенооптической плотности склеры при миопии по сравнению с эмметропией и гиперметропией, при прогрессирующей миопии по сравнению со стационарной и при осложненной миопии по сравнению с неосложненной [2, 10, 16]. Однако главными недостатками для использования этих методов выступили сложность в воспроизведении разными исследователями и ограниченная доступность использования современных кератотопографических методик, которые снижали широкое внедрение данных методик.
До сих пор оценка опорных свойств капсулы глаза разработана недостаточно точно, а изучение in vivo биомеханических свойств роговичной ткани было невозможно. В большинстве научных исследований и на практике офтальмологи ограничивались лишь определением таких простых показателей, как ригидность глаза, толщина и топография роговицы [4, 5, 23, 32, 33, 35].
Признание первоочередной роли ослабления биомеханических свойств роговицы, как ключевого фактора в патогенезе развития и прогрессирования кератоконуса, других патологических состояний и заболеваний роговицы, нашли достаточно широкое отражение в современной литературе. Проанализировав офтальмологические первоисточники, можно выделить тот факт, что активным поиском методов исследования биомеханических свойств структур и тканей глаза занимались ученые уже практически на протяжении столетия. Тем не менее проблема клинического исследования ригидности глаза все еще далека от решения. Разработка новых методов оценки биомеханических свойств тканей глаза in vivo и системы средств борьбы с развитием и прогрессированием офтальмологической патологии актуальны и своевременны для современной офтальмологии.
Наше усовершенствование заключается в направленном исследовании кератотопографических характеристик с использованием современной Шеймпфлюг-камеры в условиях нагрузки на капсулу глаза путем повышения ВГД. Благодаря разработанной конструкции прибора [13] есть возможность использовать для определения ригидности роговицы современные Шеймпфлюг-камеры, что значительно повышает точность измерения. Прибор для оценки ригидности роговицы имеет фиксированный вес и форму, что существенно сокращает время исследования и позволяет изучать результаты, которые не зависят от исполнителя и могут анализироваться и сравниваться у большого количества пациентов.
Также важно отметить, что при использовании одного и того же кератотопографа и стандартных программ, в условиях искусственного повышения ВГД, которые созданы путем двухминутной дозированной механической компрессии в 30 грамм на глазное яблоко [12, 13], зарегистрированы отчетливые данные деформации роговицы на глазах с кератоконусом, степень которых оценивается коэффициентом ригидности роговицы [18] и зависит от стадии патологического процесса. При этом наши исследования обнаружили факт относительной стабильности роговицы при эмметропии.
Результаты исследования свидетельствовали о том, что в условиях искусственно повышенного ВГД использование предложенного нами способа и прибора для оценки ригидности роговицы in vivo [12, 13] позволило не только выявить наличие биомеханических нарушений роговицы глаз пациентов с кератоконусом по сравнению с контрольными эмметропическими пациентами, но и дифференцировать характер изменений. Коэффициент ригидности роговицы во всех изучаемых случаях показывал статистически достоверные результаты, которые согласовывались с клиническим течением процесса на этих глазах.
Кроме того, исследования доказали высокую специфичность, чувствительность и точность коэффициента ригидности роговицы, изменение которого выявляло наличие биомеханических нарушений роговицы, выражало вариабельность и уровень ее деформации, коррелировало со стадией кератоконуса. Анализ результатов исследования доказал возможность использования фактора повышения показателя коэффициента ригидности роговицы выше KER > (+)6,4 % на глазах с кератоконусом в качестве критерия прогнозирования риска начала прогрессирования заболевания.
ВЫВОДЫ
Разработана адекватная методика прижизненной диагностики изменений биомеханических свойств роговицы, которая стала возможной при использовании прибора для оценки ригидности роговой оболочки глаза путем измерения деформации тканей глаза под нагрузкой. Для описания степени изменений биомеханических свойств роговицы in vivo разработан коэффициент ригидности роговицы.
Предложенный способ и прибор для оценки ригидности роговицы in vivo позволяет не только выявить наличие биомеханических нарушений роговой оболочки глаза, но и дифференцировать их различный характер.
Доказана возможность использования фактора повышения показателя коэффициента ригидности роговицы выше KER > (+)6,4 % на глазах с кератоконусом в качестве критерия прогнозирования риска начала прогрессирования заболевания.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Аветисов С. Э. Экспериментальное исследование механических характеристик роговицы и прилегающих участков склеры / С. Э. Аветисов, В. Р. Мамиконян, Н. Н. Завалишин [и др.] // Офтальмологический журнал. – 1988. – № 4. – С. 233–237.
- Аветисов Э. С. Близорукость / Э. С. Аветисов. – М. : Медицина. – 1999. – 303 с.
- Бакбардин Ю. В. Тонометрические, тонографические и гониоскопические методы исследования / Ю. В. Бакбардин, Ю. Н. Кондратенко. – К., 1998. – 33 с.
- Еричев В. П. Корнеальный гистерезис в норме и при некоторых видах офтальмопатологии / В. П. Еричев, М. В. Еремина, Л. В. Якубова [и др.] // Биомеханика глаза – 2007 : сб. тр. конф. – М., 2007. – С. 82–87.
- Кальфа С. Ф. // Сборник науч. работ глазной клиники Одесского медицинского института. – 1936. – Т. 1. – С. 51–132.
- Киваев А. А. Динамика биомикроскопических изменений роговицы при кератоконусе / А. А. Киваев, Г. А. Бабич, Т. Д. Абугова // Офтальмологический журнал. – 1979. – № 4. – С. 217–218.
- Коростелева Н. Ф. Дифференциальная диагностика атипичных плоских отслоек хориоидеи и периферических частичных отслоек сетчатки в глазах с мутными оптическими средами / Н. Ф. Коростелева, И. Г. Куман, В. А. Евлампьев // Офтальмохирургия. – 1992. – № 4. – С. 34–38.
- Котляр К. Е. Биомеханика глаза как высокоэффективный инструмент для выбора и разработки перспективных направлений клинических и экспериментальных исследований / К. Е. Котляр, Е. Н. Иомдина, И. Н. Кошиц // Биомеханика глаза – 2004 : cб. трудов IV семинара. – М., 2004. – С. 3–8.
- Моісеєнко Р. О. Офтальмологічна допомога в Україні за 2006–2011 роки / Р. О. Моісеєнко, М. В. Голубчиков, Г. О. Слабкий, С. О. Риков. – К., 2012. – 183 с.
- Обрубов С. А. Акустическая биомеханика глаза и ее значение для клиники / С. А. Обрубов, Е. И. Сидоренко, В. Н. Федорова [и др.]. – М., 2001. – 128 с.
- Обрубов С. А. Биомеханические свойства склеры в зависимости от степени ее дифференцировки / С. А. Обрубов, Е. И. Сидоренко, А. А. Древаль, С. В. Грищенко // Биомеханика глаза – 2004 : cб. трудов IV семинара. – М., 2004. – С. 67–69.
- Пат. 39262 Украина, МПК A61B 8/10. Способ оценки ригидности роговой оболочки глаза / Сергиенко Н. М., Шаргородская И. В. – № а200802125; опубл. 25.02.2009, Бюл. № 4.
- Пат. 85810 Украина, МПК A61B 3/00. Прибор для оценки ригидности роговой оболочки глаза / Сергиенко Н. М., Шаргородская И. В. – № а200807919; опубл. 25.02.2009, Бюл. № 4.
- Пучковская Н. А. Возможности прогнозирования дальнейшего прогрессирования осложненной миопии / Н. А. Пучковская, Н. С. Шульгина, Н. Н. Бушуева // Патология глазного дна : тез. докл. конф. с участием иностр. специалистов (Россия, г. Москва, 1986 г.). – М., 1986. – С. 78–79.
- Рыков С. А. Научное обоснование системы оказания офтальмологической помощи населению Украины : дис. … доктора мед. наук : 14.02.03, 14.01.18 / Рыков Сергей Александрович. – К., 2004. – 527 с.
- Тарутта Е. П. Склероукрепляющее лечение и профилактика осложнений прогрессирующей близорукости у детей и подростков : автореф. дис. … доктора мед. наук / Тарутта Елена Петровна. – М., 1993. – 51 с.
- Ферфильфайн И. Л. К вопросу о классификации близорукости / И. Л. Ферфильфайн. – Днепропетровск, 1999. – С. 96–102.
- Шаргородская И. В. Сравнительный анализ измерения биомеханических показателей роговицы при использовании различных методов / И. В. Шаргородская // Архив офтальмологии Украины. – 2016. – Т. 4, № 1. – С. 61–66.
- Amsler M. La notion du keratocone / M. Amsler // Bull Soc franc Ophthalmol. – 1951. – Vol. 64. – P. 272–275.
- Bell G. R. Biomechanical consideration of high myopia: Part I – Physiological characteristics / G. R. Bell // J Am Optom Assoc. – 1993. – Vol. 64. – P. 332–338.
- Blach R. K. Degenerative myopia / R. K. Blach // Krill’s hereditary retinal and choroidal diseases / A. E. Krill, D. B. Archer (eds). – Maryland : Harper &Row, 1977. – Vol. 2. – P. 911–937.
- Bron A. J. Keratoconus / A. J. Bron // Cornea. – 1988. – Vol. 163. – Р. 163–169.
- Curtin B. J. The myopias: basic science and clinical management / B. J. Curtin. – Philadelphia, 1985. – 120 p.
- Duke-Elder S. Keratoconus / S. Duke-Elder, A. G. Leigh // System of Ophthalmology. – 1965. – Vol. 8. – P. 964–976.
- Grabner G. Dynamic corneal imaging / G. Grabner, R. Eilmdteiner, C. Steindl, [et al.] // J Cataract Refract Surg. – 2005. – Vol. 31. – P. 163–174.
- Greene P. R. Closed-form ametropic pressure-volume and ocular rigidity solutions / P. R. Greene // Am J Optom Physiol Opt. – 1985. – Vol. 62. – Р. 870–878.
- Haque S. Corneal and epithelial thickness in keratoconus: a comparison of ultrasonic pachymetry, Orbscan II, and optical coherence tomography / S. Haque, T. Simpson, L. Jones // J Cataract Refract Surg. – 2006. – Vol. 22. – Р. 486–493.
- Jaycock P. D. Interferometric technique to measure biomechanical changes in the cornea induced by refractive surgery / P. D. Jaycock, L. Lobo, J. Ibrahim, [et al.] // J Cataract Refract Surg. – 2005. – Vol. 31. – Р. 175–184.
- Lichtinger A. Intraocular lenses for presbyopia correction: past, present, and future / A. Lichtinger, D. S. Rootman // Curr Opin Ophthalmol. – 2012. – Vol. 23. – P. 40–46.
- Maeda N. Artifcial intelligence schemes for classifcation of corneal topography / N. Maeda // Proceedings of the International Society for Eye Research (USA, New Mexico, Santa Fe, 2000). – Vol. 14. – P. 70.
- Patel S. Normal human keratocyte density and corneal thickness measurement by using confocal microscopy in vivo / S. Patel, J. McLaren, D. Hodge, [et al.] // Invest Ophthalmol Vis Sci. – 2001. – Vol. 42. – P. 333–339.
- Sergienko N. M. Determining corneal hysteresis and preexisting intraocular pressure / N. M. Sergienko, I. V. Shargorodska // J Cataract Refract Surg. – 2009. – Vol. 35. – P. 2033–2034.
- Simon G. Effect of corneal hydration on Goldman applanation tonometry and corneal topography / G. Simon, R. H. Small, Q. Ren, [et al.] // Refract Corneal Surg. – 1993. – Vol. 9. – P. 110–117.
- Ucakhan O. O. In vivo confocal microscopy fndings in keratoconus / O. O. Ucakhan, A. Kanpolat, N. Ylmaz, [et al.] // Eye Contact Lens. – 2006. – Vol. 32. – P. 183–191.
- Wollensak J. Neue Befunde bei Keratokonus / J. Wollensak, A. Ihme, T. Seiler // Fortschr Ophthalmol. – 1987. – Vol. 84. – P. 28–32.
REFERENCES
- Avetisov S. E. Mamikonyan V. R., Zavalishin N. N., Nenyukov A. K. Experimental study of mechanical properties of the cornea and sclera adjacent areas. Oftalmologicheskiy zhurnal [Journal of Ophthalmology]. 1988; (4): 233–237 (in Russian).
- Avetisov E. S. Myopia. Moscow, Medicina, 1999, 303 p. (in Russian).
- Bakbardin Y. V., Kondratenko U. N. Tonometric, tonographic and gonioskopic research methods. Kyiv, 1998, 33 p. (in Russian).
- Erichev V. P., Eremina M. V., Yakubova L. V., Arezheva Yu. A. Corneal hysteresis in normal conditions and in certain types of ophthalmopathology. Proceeding of the “Biomekhanika glaza – 2007” (Russia, Moscow, 2007). Moscow, 2007, pp. 82–87 (in Russian).
- Kalfa S. F. Sbornik nauchnih rabot glaznoy kliniki Odeskogo medicinskogo instituta [Collected scientifc. Works Eye Clinic of the Odessa Medical Institute]. 1936; (1): 51–132 (in Russian).
- Kivaev A. A., Babich G. A., Abugova T. D. Dynamics biomicroscopy of the cornea changes in keratoconus. Oftalmologicheskiy zhurnal [Journal of Ophthalmology]. 1979; (4): 217–218 (in Russian).
- Korostelyova N. F., Koeman I. G., Evlampiev V. A. Differential diagnosis of atypical flat choroidal detachments and peripheral partial retinal detachments in the eyes bleary optical media. Oftalmohirurgiya [Ophthalmosurgery]. 1992; (4): 34–38 (in Russian).
- Kotlyar K. E., Iomdin E. N., Koshits J. H. Biomechanics eyes as a highly effective tool for the selection and development of promising areas of clinical and experimental studies. Proceedings of the “Biomekhanika glaza” (Russia, Moscow, 2004). Moscow, 2004, pp. 3–8 (in Russian).
- Moiseienko R. O., Holubchykov M. V., Slabkyi H. O., Rykov S. O. Ophthalmological help in Ukraine for 2006–2011. Kyiv, 2012, 183 p. (in Ukrainian).
- Obrubov S. A., Sidorenko E. I., Fedorova V. N., Dubovaya T. K., Dreval A. A. Acoustic biomechanics of the eye and its signifcance for the clinic. Moscow, 2001, 128 p. (in Russian).
- Obrubov S. A., Sidorenko E. I., Dreval A. A., Grischenko S. V. Biomechanical properties of sclera depending on the degree of differentiation. Proceedings of the “Biomekhanika glaza” (Russia, Moscow, 2004). Moscow, 2004, pp. 67–69 (in Russian).
- Sergienko N. M., Shargorodskaya I. V. A method of estimating the rigidity of the cornea. Ukraine. Patent 39262, February 25, 2009 (in Russian).
- Sergienko N. M., Shargorodskaya I. V. The device for assessing the stiffness of the cornea. Ukraine. Patent 85810, February 25, 2009 (in Russian).
- Puchkovskaya N. A. Shulgin N. S., Bushueva N. N. Features predict further progression of myopia complicated. Proceedings of the “Patopoligya glaznogo dna” (Russia, Moscow, 1986). Moscow, 1986, pp. 78–79 (in Russian).
- Rykov S. A. Scientifc substantiation of system of providing eye care to the population of Ukraine. Dr. Med. Sci. Diss. Kyiv, 2004, 527 p. (in Russian).
- Tarutta E. P. Sclera treatment and prevention of complications of progressive myopia in children and adolescents. Dr. Sc. Thesis. Moscow, 1993, 51 p. (in Russian).
- Ferflfayn I. L. On the question of classifcation of myopia. Dnepropetrovsk, 1999, pp. 96– 102 (in Russian).
- Shargorodskaya I. V. Comparative analysis of the measurements of biomechanical parameters of the cornea using various methods. Arhiv oftalmologii Ukraini [Archives of Ophthalmology Ukraine]. 2016; (4): 61–66 (in Russian).
- Amsler M. La notion du keratocone. Bull Soc franc Ophthalmol. 1951; (64): 272–275.
- Bell G. R. Biomechanical consideration of high myopia: Part I – Physiological characteristics. J Am Optom Assoc. 1993; (64): 332–338.
- Blach R. K. Degenerative myopia. In: Krill A. E., Archer D. B., eds. Krill’s hereditary retinal and choroidal diseases. Maryland, Harper and Row, 1977; (2): 911–937.
- Bron A. J. Keratoconus. Cornea. 1988; (163): 163–169.
- Curtin B. J. The myopias: Basic Science and clinical management. Philadelphia, 1985, 120 p.
- Duke-Elder S., Leigh A. G. Keratoconus. System of Ophthalmology. 1965; (8): 964–976.
- Grabner G., Eilmdteiner R., Steindl C., Ruckhofer J., [et al.] Dynamic corneal imaging. J Cataract Refract Surg. 2005; (31): 163–174.
- Greene P. R. Closed-form ametropic pressure-volume and ocular rigidity solutions. Am J Optom Physiol Opt. 1985; (62): 870–878.
- Haque S., Simpson T., Jones L. Corneal and epithelial thickness in keratoconus: a comparison of ultrasonic pachymetry, Orbscan II, and optical coherence tomography. J Cataract Refract Surg. 2006; (22): 486–493.
- Jaycock P. D., Lobo L., Ibrahim J., Tyrer J., Marshall J. Interferometric technique to measure biomechanical changes in the cornea induced by refractive surgery. J Cataract Refract Surg. 2005; (31): 175–184.
- Lichtinger A., Rootman D. S. Intraocular lenses for presbyopia correction: past, present, and future. Curr Opin Ophthalmol. 2012; (23): 40–46.
- Maeda N. Artifcial intelligence schemes for classifcation of corneal topography. Proceedings of the International Society for Eye Research (USA, New Mexico, Santa Fe, 2000). New Mexico, 2000; (14): 70.
- Patel S., McLaren J., Hodge D., Bourne W. Normal human keratocyte density and corneal thickness measurement by using confocal microscopy in vivo. Invest Ophthalmol Vis Sci. 2001; (42): 333–339.
- Sergienko N. M., Shargorodska I. V. Determining corneal hysteresis and preexisting intraocular pressure. J Cataract Refract Surg. 2009; (35): 2033–2034.
- Simon G., Small R. H., Ren Q., Parel J. M. Effect of corneal hydration on Goldman applanation tonometry and corneal topography. Refract Corneal Surg. 1993; (9): 110–117.
- Ucakhan O. O., Kanpolat A., Ylmaz N., Ozkan M. In vivo confocal microscopy fndings in keratoconus. Eye Contact Lens. 2006; (32): 183–191.
- Wollensak J., Ihme A., Seiler T. Neue Befunde bei Keratokonus. Fortschr Ophthalmol. 1987; (84): 28–32.
Стаття надійшла в редакцію 13.05.2016 р.
Рецензія на статтю надійшла в редакцію 15.06.2016 р.