- Автор: Super User
- Категорія: №3 (05) 2016
- Опубліковано: 20 квітня 2018
- Перегляди: 4649
УДК 617.7‒007.681‒085
Абышева Л. Д.1, Авдеев Р. В.2, Александров А. С.3, Басинский А. С.4, Блюм Е. А.5, Брежнев А. Ю.6, Газизова И. Р.7, Галимова А. Б.8, Гапонько О. В.3, Гарькавенко В. В.9, Гетманова А. М.10, Городничий В. В.3, Горшкова М. С.11, 12, Гусаревич А. А.13, Дорофеев Д. А.14, Жаворонков С. А.11, Завадский П. Ч.15, Захидов А. Б.16, Зверева О. Г.17, Каримов У. Р.18, Кулик А. В.19, Куроедов А. В.3, 12, Ланин С. Н.20, Ловпаче Дж. Н.21, Лоскутов И. А.22, Молчанова Е. В.23, Нефедов Н. А.3, Огородникова В. Ю.3, Онуфрийчук О. Н.24, Опенкова Е. Ю.25, Петров С. Ю.26, Рожко Ю. И.27, Сиденко Т. А.28, Таштитова Л. Б.1, Фомин Н. Е.12, Худжатова М. С.1
1КазНИИ ГБ, г. Алматы, Казахстан;
2ГБОУ ВПО ВГМА им. Н. Н. Бурденко, г. Воронеж, Россия;
3ФКГУ «МУНКЦ им. П. В. Мандрыка» МО РФ, г. Москва, Россия;
4ООО «Офтальмологический центр проф. Басинского С. Н.», г. Орел, Россия;
5КДП Областной офтальмологической больницы, г. Шымкент, Казахстан;
6ГОУ ВПО КГМУ, г. Курск, Россия;
7ГБОУ ВПО БГМУ, г. Уфа, Россия;
8ФГБУ «Всероссийский центр глазной и пластической хирургии» МЗ РФ, г. Уфа, Россия;
9ГОУ ВПО КГМУ им. проф. В. Ф. Войно-Ясенецкого, г. Красноярск, Россия;
10Областная больница № 1, отделение микрохирургии глаза, г. Брянск, Россия;
11ГБУЗ ГКБ № 15 им. О. М. Филатова, г. Москва, Россия;
12ГБОУ ВПО РНИМУ им. Н. И. Пирогова, г. Москва, Россия;
13НУЗ «Дорожная клиническая больница» ОАО «РЖД», Междорожный центр микрохирургии глаза, г. Новосибирск, Россия;
14ГБУЗ ОКБ № 3, г. Челябинск, Россия;
15УО ГрГМУ, г. Гродно, Беларусь;
16Клиника микрохирургии глаза ЧП «SAIF OPTIMA», г. Ташкент, Узбекистан;
17ГАУЗ РКОБ МЗ РТ, г. Казань, Россия;
18Сырдарьинская областная офтальмологическая больница, г. Гулистан, Узбекистан;
19ОАО «Медицина», г. Москва, Россия;
20КГБУЗ ККОКБ им. П. Г. Макарова, г. Красноярск, Россия;
21ФГБУ МНИИ ГБ им. Гельмгольца, г. Москва, Россия;
22НУЗ ДКБ им. Н. А. Семашко, г. Москва, Россия;
23ГБОУ ВПО ГМА, г. Омск, Россия;
24ГБУЗ ДЦ № 7 (глазной), г. Санкт-Петербург, Россия;
25ГБОУ ВПО ЮУГМУ, г. Челябинск, Россия;
26ФГБУ НИИ ГБ РАМН, г. Москва, Россия;
27ГУ РНПЦ РМ и ЭЧ, УО ГомГМУ, г. Гомель, Беларусь;
28МБУЗ ГКП № 5, г. Пермь, Россия
РЕЗЮМЕ
Актуальность. Дискуссия в области разграничения нормы и патологии при изучении офтальмотонуса у здоровых лиц и у пациентов с глаукомой продолжается в течение последних нескольких десятилетий.
Цель. Цель работы – изучить характеристики офтальмотонуса у пациентов с первичной открытоугольной глаукомой на фоне проводимого лечения для обнаружения прогрессирования заболевания и определения оптимальных показателей.
Материал и методы. В протокол исследования были включены данные 812 человек (812 правых глаз), из них больных с глаукомой – 637 пациентов, а группу контроля составили 175 человек. Средний возраст всех обследованных составил 71,8 ± 0,28 лет (72,00 (66,00; 77,00)), а установленный анамнез заболевания у больных глаукомой – 5,41 ± 0,17 лет. Исследовали остроту зрения, определяли клиническую рефракцию, измеряли тонометрический уровень внутриглазного давления, толщину оптической зоны роговицы и исследовали режим инстилляций антиглаукомных гипотензивных препаратов.
Результаты. В возрастной группе от 60 до 69 лет уровень внутриглазного давления у лиц с далеко зашедшей стадией глаукомы был статистически достоверно выше, чем у больных с развитой стадией заболевания и у здоровых лиц. Не было обнаружено различий и при изучении показателя центральной толщины роговицы между здоровыми и больными глаукомой лицами женского и мужского пола, а также при сравнении данных пациентов с разными стадиями заболевания. Уровень офтальмотонуса был выше в группе, которая получала нефиксированную комбинацию, содержащую бета-адреноблокаторы и простагландины, независимо от стадии глаукомы. Компенсация офтальмотонуса в соответствии с общепринятыми нормами показателей внутриглазного давления была установлена у 69,93 % пациентов с развитой стадией и у 14,42 % больных с далеко зашедшей стадией глаукомы.
Вывод. Установленные данные могут быть использованы для клинических рекомендаций с целью определения оптимальных границ офтальмотонуса, а также при выборе оптимального(ых) препарата(ов) на старте лечения и при динамическом наблюдении больных с развитой и далеко зашедшей стадиями глаукомы.
Ключевые слова: глаукома, уровень внутриглазного давления, толщина роговицы в центральной оптической зоне, антиглаукомные гипотензивные препараты.
ВВЕДЕНИЕ
Нетрудно заметить, сколь неравнозначную роль в распознавании глаукомы имеют разные виды клинических исследований [14]. Более того, даже их применение в комбинации и при динамическом наблюдении в значительной мере неравноценно. Поскольку ранее было неоднократно доказано, что нарушение функции офтальмотонуса является предрасполагающим клиническим механизмом для развития глаукомы, то именно его изучение столь продолжительное время привлекает пристальное внимание исследователей, являясь подробно обоснованным фактором риска прогрессирования глаукомы и развития глаукомной оптической нейропатии (ГОН) [20, 25]. В большинстве случаев понижение уровня внутриглазного давления (ВГД) может быть единственным подтвержденным способом профилактики глаукомы у пациентов с офтальмогипертензией и замедления прогрессирования ГОН. Вместе с тем ГОН отмечается и у достаточного количества пациентов с так называемым «контролируемым» уровнем ВГД [26, 35]. В связи с этим до настоящего времени не утихает дискуссия относительно статистических норм офтальмотонуса, которые, как известно, могут различаться более чем на 10 мм рт. ст., оставаясь при этом в границах «нормальных» значений [7]. Казалось бы, что проще – исследовать уровни ВГД здоровых людей и затем смело экстраполировать их значения при лечении пациентов с глаукомой? К сожалению, анализ результатов проведенных ранее популяционных исследований делает это утверждение уже не столь очевидным. Так, в работе Паниной Н. Б. (1971) «О нормах внутриглазного давления», в которой автор провела обследование 4 703 здоровых лиц (9 406 глаз) в возрасте от 30 до 69 лет, было установлено, что наиболее часто встречаемый уровень ВГД среди мужчин и женщин равен 20 мм рт. ст. (21,5 и 22,4 % соответственно) [27]. В целом в группе мужчин (82,7 %) и женщин (83,5 %) показатели офтальмотонуса находились в границах от 18 до 23 мм рт. ст. Через 30 лет другие ученые (Алексеев В. Н., Егоров Е. А., Мартынова Е. Б., 2001), изучив данные 2 481 здорового человека (4 902 глаза), установили среднюю величину тонометрического уровня ВГД, равную 19,9 ± 0,03 мм рт. ст. [7]. Авторы обнаружили и доказали наличие зоны «средней нормы» (от 19 до 22 мм рт. ст.), характерной для 72,2 % популяции. Однако ранее, изучая уровни ВГД в зависимости от длительности течения глаукомы, Водовозов А. М. отметил, что величина толерантного давления, хотя и несколько выше при анамнезе 0–4 года (срок, характерный для начальной стадии заболевания), но не превышает показатели лиц, болеющих глаукомой 15–19 лет (19,7 и 18,0 мм рт. ст., t = 1,17; p > 0,05) [13]. Эта доказанная клиническая особенность глаукомы свидетельствует о том, что пациенты, скорее всего, обладают разной чувствительностью к повышенному уровню ВГД, или о том, что существуют иные характеристики давления, влияющие на прогрессирование болезни, в том числе и факторы, влияющие на измерение офтальмотонуса [31, 33]. В первом случае речь идет об исследованиях в области толерантности зрительного нерва и слоя нервных волокон сетчатки к изменениям офтальмотонуса, а также о трактовке возможных понятий «буферного» диапазона шкалы уровней ВГД, в пределах которого изменение индивидуального офтальмотонуса не приводит к развитию или прогрессированию глаукомы [6, 11]. К числу параметров, влияющих на проведение измерений, помимо собственно погрешности методов, следует отнести геометрические параметры и механические свойства фиброзной оболочки глаза [5, 10]. В последние десятилетия значительное место в профессиональной прессе отводится наиболее изученному показателю, коим является толщина роговицы в ее оптической зоне (ЦТР) [12, 18, 23, 28, 29, 34]. Так, например, в 1975 году Ehlers N. c соавторами доказали, что ЦТР является крайне важным биометрическим параметром, несущим новую информацию, напрямую связанную с показателями офтальмотонуса [30]. Авторы выполнили канюлирование 29 человеческих глаз и сравнили полученные результаты уровней ВГД в зависимости от установленной толщины роговицы. Было обнаружено, что изменение толщины ЦТР на 70 мкм коррелирует с изменениями офтальмотонуса в пределах 5 мм рт. ст. Такие результаты стали основанием для того, чтобы исключить индивидуальные погрешности измерений в зависимости от состояния ЦТР. В начале 90-х годов прошлого века было установлено, что аппланационная тонометрия дает наиболее корректные результаты при толщине роговицы в интервале от 540 до 550 мкм [36]. Что касается наиболее распространенной в отечественной клинической практике тонометрии с использованием тонометра Маклакова, то ранее было обнаружено, что у здоровых лиц в возрасте от 56 до 70 лет при средней ЦТР, равной 559,61 ± 37,56 мкм, уровень ВГД составляет 18,11 ± 4,64 мм рт. ст. [15]. Эти же авторы выявили, что чем тоньше роговица, тем больший процент пациентов с далеко зашедшей стадией глаукомы в такой популяции. Исследователи резюмировали, что у лиц с «тонкой» роговицей происходит заниженная оценка уровня ВГД и, как следствие, дальнейшее неконтролируемое прогрессирование ГОН. В другой работе при проведении обследования здоровых добровольцев (средний возраст – 41,4 ± 18,1 лет) был подтвержден характер обнаруженных взаимоотношений: при показателе ЦТР 551–560 мкм уровень ВГД был равен 18,2 ± 2,11 мм рт. ст. [8]. Уровень офтальмотонуса у лиц с глаукомой, сопоставимых по возрасту и показателю ЦТР, составил 19,3 ± 1,72 мм рт. ст. Отметим, что во всех приведенных выше примерах уровень офтальмотонуса и здоровых лиц, и больных с глаукомой колеблется в интервале 18–20 мм рт. ст. Кроме этого, указанные значения сопоставимы с результатами, полученными в масштабных многоцентровых эпидемиологических исследованиях, в которых было установлено, что уровень офтальмотонуса пациентов с продвинутыми стадиями первичной открытоугольной глаукомы (ПОУГ) на фоне лечения не соответствует рекомендованным значениям [1–4, 16, 17, 24]. Таким образом, разграничение нормы и патологии в области изучения офтальмотонуса продолжает носить дискуссионный характер. Это подтолкнуло ученых к последовательному изучению другого ракурса этого вопроса: необходимо ли измерение ЦТР для прогноза возможного прогрессирования глаукомы и изменяется ли этот показатель у больных глаукомой иначе, чем у здоровых лиц? [21]. Однако для доказательства этого предположения необходимо провести длительное (не менее двух десятилетий) динамическое наблюдение с продолжительным совместным мониторингом показателей офтальмотонуса и ЦТР. В настоящее время таких законченных исследований нет. Таким образом, остаются актуальными вопросы стандартизации измерений уровня ВГД и индивидуальный подход с целью аккуратного определения нормальных и патологических его показаний в различных популяциях, сопоставимых по различным клиническим ситуациям, в первую очередь по возрасту, полу и показателю ЦТР [9, 19]. Результаты таких исследований могут стать основанием для пересмотра границ безопасных уровней офтальмотонуса.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Целью данной работы стало изучение характеристик офтальмотонуса у пациентов с ПОУГ при лечении разными группами гипотензивных препаратов для определения оптимальных показателей в зависимости от возраста, анамнеза, стадии заболевания и толщины роговицы в оптической зоне.
МАТЕРИАЛ И МЕТОДЫ
Многоцентровое научно-клиническое исследование проводилось 36 врачами в период с июля по ноябрь 2014 года на 28 базах в 4 странах СНГ (Беларусь, Казахстан, Россия, Узбекистан). В модели наблюдательного комбинированного исследования изучали такие показатели, как: возраст, анамнез, стадии заболевания, уровни офтальмотонуса на фоне лечения и, собственно, гипотензивный режим, а также состояние толщины роговицы в оптической зоне у пациентов с развитой и далеко зашедшей стадиями первичной ПОУГ. Первым этапом стал анализ данных анамнеза болезни. Далее, на момент фактического включения пациента в исследование, производилось документальное подтверждение стадии заболевания с дополнительным измерением уровня ВГД, измерением ЦТР, изучением медикаментозного режима и сравнением полученных данных с результатами контрольной группы. Участие пациентов в исследовании было подтверждено их письменным согласием.
В итоговый протокол исследования были включены данные 812 человек (812 правых глаз), что составило 93,01 % (пациентов/глаз) от общего числа полученных протоколов. Исключенные из исследования протоколы содержали неполный набор результатов. На момент диагностирования заболевания у пациентов были начальная (n = 191), развитая (n = 365) и далеко зашедшая (n = 81) стадии ПОУГ. На момент включения в исследование пациентов-мужчин было 269 человек (33,1 %), женщин – 543 (66,9 %). Число больных с глаукомой было 637 человек (78,45 %), контрольную группу составили 175 здоровых лиц (21,55 %). Количество глаз пациентов с развитой стадией глаукомы составило 429 (67,35 %), с далеко зашедшей – 208 (32,65 %). Возраст на момент диагностирования заболевания находился в пределах 58–74 лет, при этом средний возраст составил 66,4 ± 0,29 лет; 66,00 (61,00; 71,00). Возраст на момент включения в исследование находился в интервале 65–79 лет (средний возраст – 71,8 ± 0,28 лет; 72,00 (66,00; 77,00)). Средний установленный анамнез заболевания составил 5,41 ± 0,17 лет; 4,00 (2,00; 7,00).
Критерии включения и исключения
Критериями включения стали: пациенты (только правые глаза) европеоидной расы с развитой и далеко зашедшей стадиями ПОУГ (с псевдоэксфолиативным синдромом или без); возраст: от 35 до 89 лет (предпочтительно пожилой и старческий, от 60 до 89 лет, согласно классификации Всемирной организации здравоохранения от 2012 года, www.who.int/ru); регион проживания: страны СНГ (Беларусь, Казахстан, Россия, Узбекистан); установленный анамнез заболевания: предпочтительно от 5 до 15 лет; клиническая рефракция: не более ±3,0 дптр, астигматизм не более ±1,5 дптр; толщина роговицы в оптической зоне: от 520 до 580 мкм; режим местной антиглаукомной гипотензивной терапии: пациенты должны были получать простагландины (ПГ) и/или фиксированную/нефиксированную комбинации ПГ и бета-адреноблокаторов (ББ). Критериями исключения стали следующие характеристики: пациенты с любой другой формой первичной и вторичной глаукомы, кроме указанной выше; клиническая рефракция других значений, нежели указано выше; выраженные помутнения оптических сред, искажающие или не позволяющие проводить исследование глазного дна и выполнение стандартной автоматической периметрии (САП); кератотомия и/или другие операции на роговице; состояния после травм органа зрения; любые заболевания сетчатки, влияющие на показания САП (например, любая форма и стадия возрастной макулодистрофии, изменения макулярной области вследствие диабета, состояния после тромбозов центральной вены сетчатки или ее ветвей, а также окклюзий центральной артерии сетчатки); пациенты с общими заболеваниями, требующими гормональной терапии; оперативное офтальмологическое лечение в анамнезе, проведенное не ранее 6 месяцев до момента включения пациента в исследование и прошедшее без осложнений; сахарный диабет; системные заболевания соединительной ткани.
Верификация диагнозов и методы
Во всех случаях диагноз был установлен в соответствии с системой дифференциальной диагностики заболеваний и подтвержден специальными методами исследования. Стадия глаукомы на момент первичного диагностирования заболевания устанавливалась по данным медицинской документации (на основании данных тонометрии, офтальмоскопии и кинетической/статической периметрии). Стадия глаукомы на момент включения пациентов в исследование была подтверждена данными офтальмоскопии и/или фундус-фотографирования, и/или оптической когерентной томографии, и/или Гейдельбергской томографии и САП, выполненной на приборах Humphrey 745i/750i (Carl Zeiss Meditec Inc., США) с использованием программы пороговой периметрии SITA Threshold 30-2. Исследовалась острота зрения, определялась клиническая рефракция, измерялся тонометрический уровень внутриглазного давления (ВГД, тонометрия по Маклакову грузом 10 г) в интервале от 10 до 12 часов утра. Исследования в подгруппах производилось на основании компенсации уровня ВГД. Компенсацию и субкомпенсацию этого показателя вычисляли согласно оптимальным характеристикам верхних границ офтальмотонуса у больных глаукомой на основании данных клинических рекомендаций Российского глаукомного общества от 2011 года. Для проведения расчетов использовались их максимальные значения в зависимости от стадии болезни на фоне применения местной гипотензивной терапии. Измерялась ЦТР с использованием методов оптической когерентной томографии (ОКТ) и ультразвука (УЗИ).
Методы статистического анализа
Обработка полученных данных проводилась одним исследователем с использованием программы Statistica (версии 8.0, StatSoft, Австралия – США) с последующей проверкой полученных результатов двумя другими исследователями в неза висимом режиме. Приводимые параметры, имеющие нормальное распределение, были представлены в формате: М ± σ, где М – среднее значение, σ – стандартное отклонение среднего значения. Распределение количественных параметров было приведено в соответствии с W-критерием Шапиро – Уилка. Параметры, имеющие распределение, отличное от нормального, были представлены в формате: Мe (Q25 %; Q75 %), где Мe – медиана, Q25 % и Q75 % – квартили. При нормальном распределении параметров для сравнения двух независимых групп или повторных внутригрупповых изменениях использовался t-критерий Стьюдента. При отличном от нормального распределении параметров при сравнении нескольких независимых выборок использовался анализ для попарного сравнения двух независимых выборок – Z-аппроксимация U-критерия Манна – Уитни, для повторных внутригрупповых сравнений применялась Z-аппроксимация T-критерия Вилкоксона. С целью анализа взаимосвязи между признаками использовали непараметрический ранговый r-коэффициент корреляции Спирмена, а критический уровень значимости при проверке статистических гипотез принимался равным < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В таблицах 1 и 2 представлены результаты, характеризующие возраст здоровых лиц (контрольная группа) и пациентов с глаукомой на момент диагностирования заболевания и на момент включения в исследование (2014 год), а также сроки от начала заболевания (анамнез). Первичный подсчет этого показателя производился на основе статистических данных, полученных из амбулаторных карт пациентов.
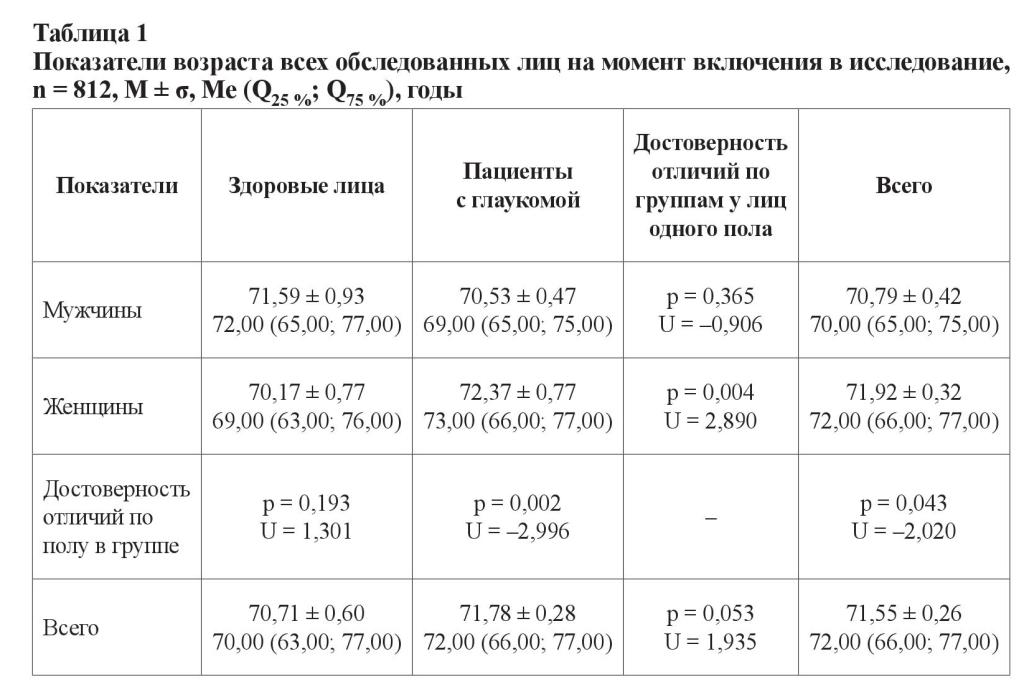
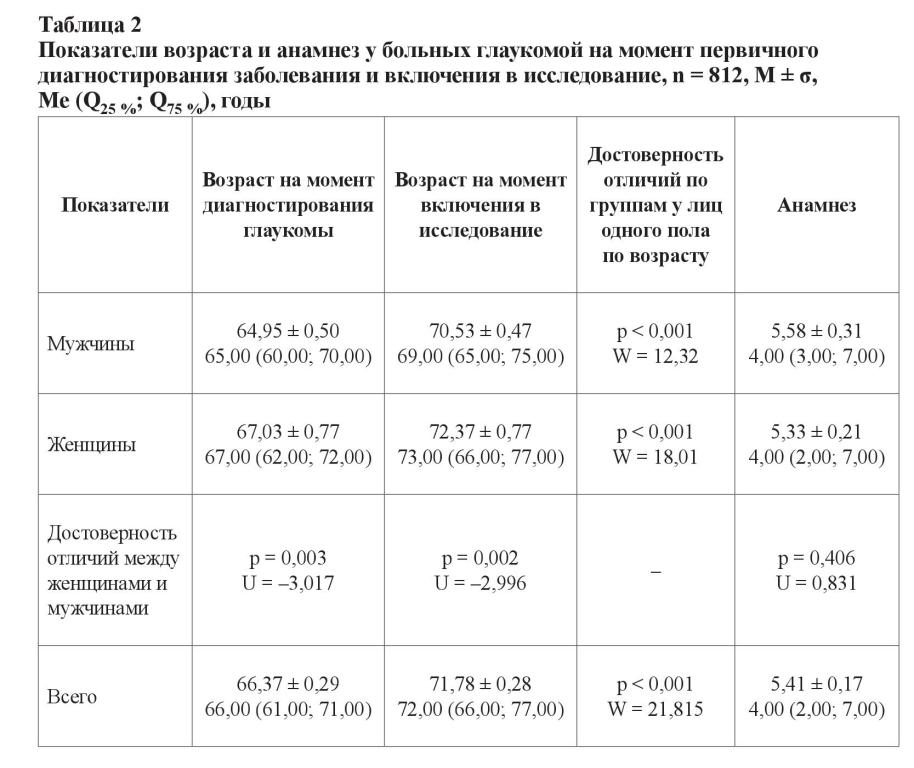
Средний возраст всех включенных в исследование лиц составил 71,55 ± 0,26 лет; 72,00 (66,00; 77,00). Среди здоровых лиц возраст мужчин и женщин не отличался (p = 0,193; U = 1,301). Больные глаукомой пациенты женского пола в среднем были старше пациентов-мужчин на 2 года (p = 0,002; U = –2,996).
Из таблицы 2 видно, что у больных глаукомой возраст достоверно отличался в гендерных подгруппах как на момент диагностирования заболевания, так и на момент включения в исследование (p < 0,001). Средний анамнез заболевания составил около 5,41 ± 0,17 лет; 4,00 (2,00; 7,00), при этом почти у 50 % пациентов он находился в интервале от 2 до 7 лет и не отличался в гендерных подгруппах. На момент диагностирования глаукомы средний возраст достоверно отличался в зависимости от стадии болезни (p = 0,004; U = –2,844). Анамнез для лиц со II стадией составил 5,01 ± 0,19 лет; 4,00 (2,00; 6,00), а для больных с III стадией – 6,23 ± 0,33 лет; 5,00 (3,00; 8,00), и имел статистически значимые различия (p < 0,001; U = –3,534).
Изучение прогрессирования глаукомы носит сугубо практический характер. Это связано с необходимостью коррекции лечения и возможностью прибегнуть к хирургической тактике. Принимая во внимание прогредиентно текущий характер заболевания, нами были проанализированы показатели прогрессирования (таблица 3).
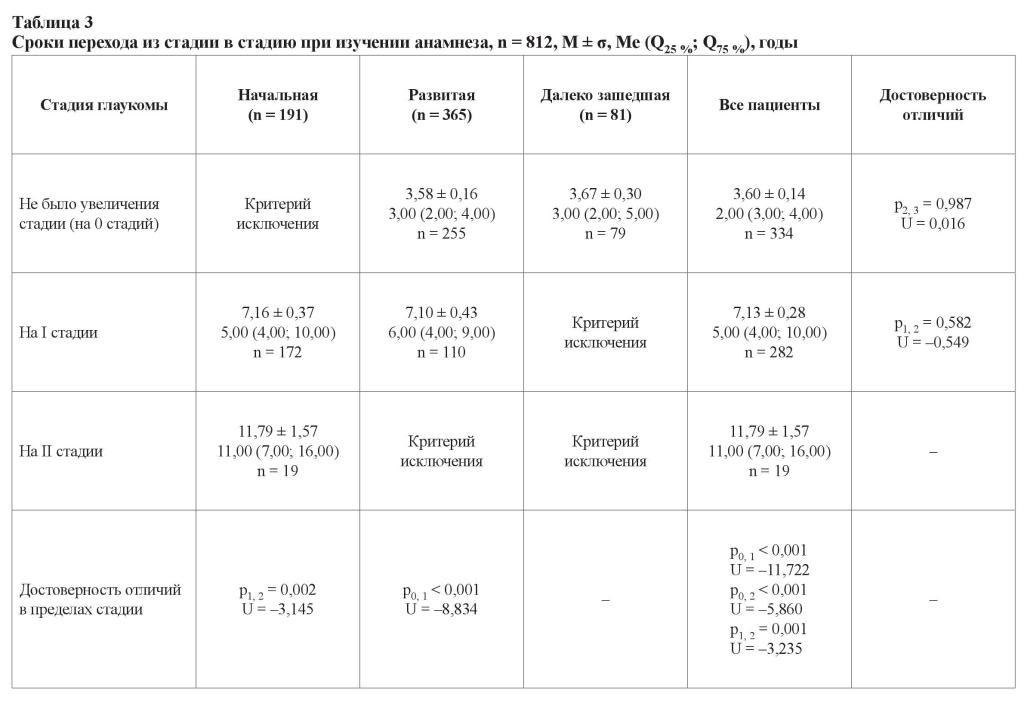
Стадия глаукомы не изменялась у пациентов с продвинутыми стадиями глаукомы за одинаковый промежуток времени, составивший около 3,0 лет (от 3,58 ± 0,16 до 3,67 ± 0,30 лет соответственно). У пациентов с I и II стадиями глаукома прогрессировала на одну стадию за временной промежуток, составивший 7,16 ± 0,37 и 7,10 ± 0,43 лет соответственно, и в 50 % случаев интервал был от 4 до 10 лет. Таким образом, для больных с этими стадиями степень прогрессирования заболевания зависит от анамнеза прямо пропорционально. В среднем утяжеления состояния не наблюдалось в течение 2,00 (3,00; 4,00) лет, прогрессирование на одну стадию – за 5,00 (4,00; 10,00) лет (n = 282), на две стадии – за 11,00 (7,00; 16,00) лет, но таких пациентов было немного (n = 19). Прогрессирование до слепоты (терминальная стадия) было отмечено больше, чем за 11 лет.
Изменения, вызванные глаукомой, напрямую связаны с уровнем ВГД, и его понижение является единственным подтвержденным способом замедления прогрессирования глаукомной оптической нейропатии. В связи с этим был проведен анализ показателей офтальмотонуса у пациентов с глаукомой и у здоровых лиц в соответствии с представленными выше гендерными и возрастными группами, а также различными временными периодами измерения (таблицы 4–6).
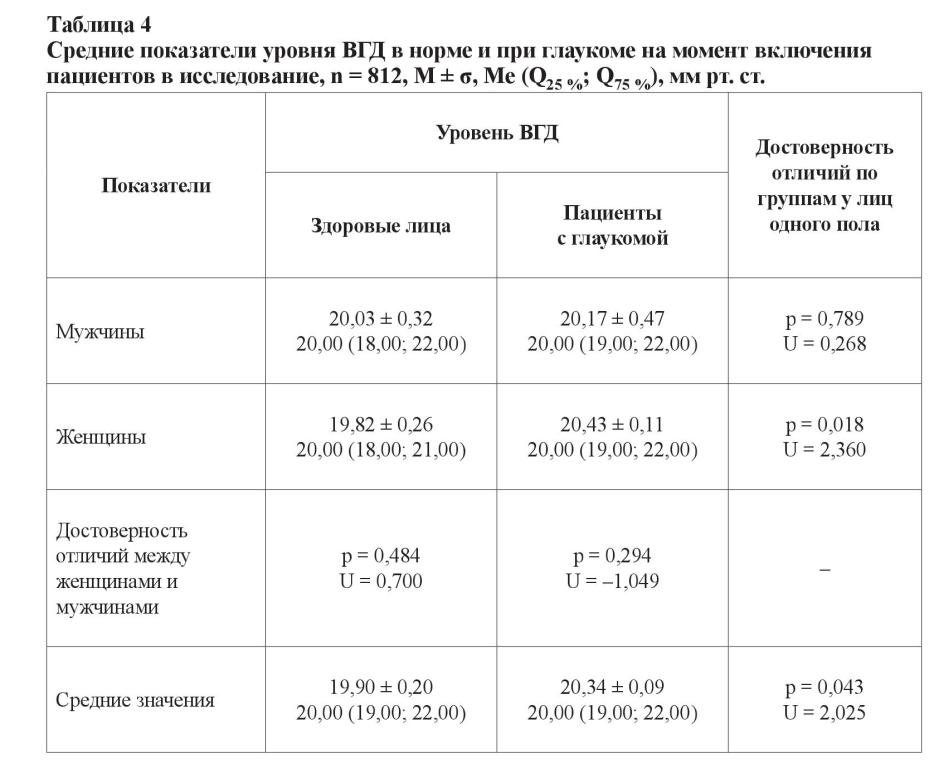
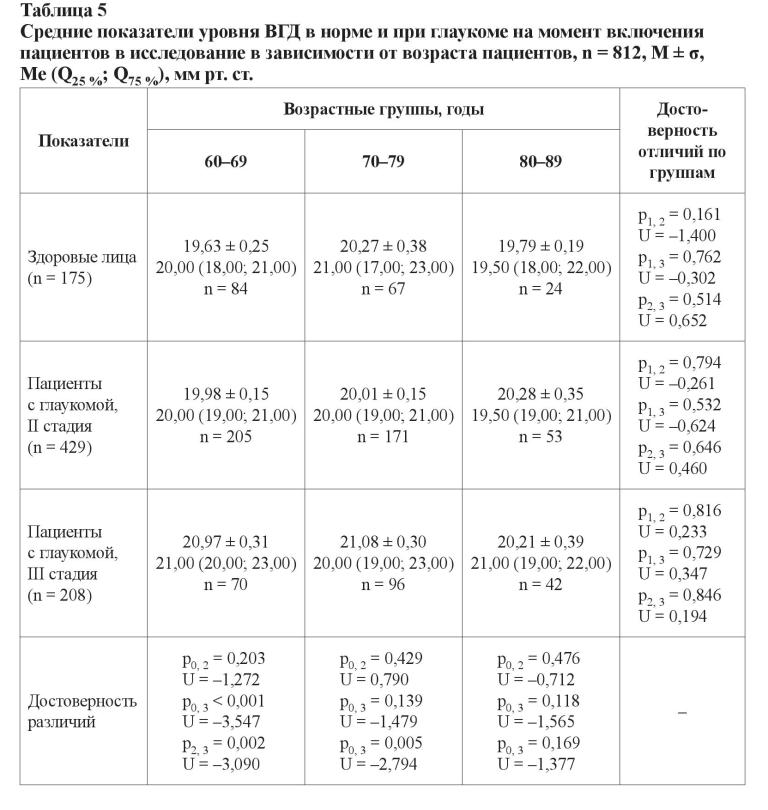
Уровень ВГД у здоровых мужчин и женщин не отличался, равно как и у пациентов с глаукомой (p > 0,05). При этом уровень офтальмотонуса у больных глаукомой женщин был выше, чем у здоровых лиц, за счет показателей больных с далеко зашедшей стадией (p = 0,018; U = 2,360). В целом уровень ВГД у здоровых лиц был меньше, чем у больных с глаукомой (p = 0,043; U = 2,025). Для пациентов с развитой стадией глаукомы средний уровень ВГД составил 20,03 ± 0,10 мм рт. ст. (20,00 (19,00; 21,00)), для больных с далеко зашедшей стадией заболевания – 20,99 ± 0,19 мм рт. ст. (21,00 (19,00; 23,00)). Достоверность различий при сравнении с контрольной группой и между собой представлена значениями: p0, 2 = 0,461, U = –0,736; p0, 3 < 0,001, U = –3,822; p2, 3 < 0,001, U = –4,485.
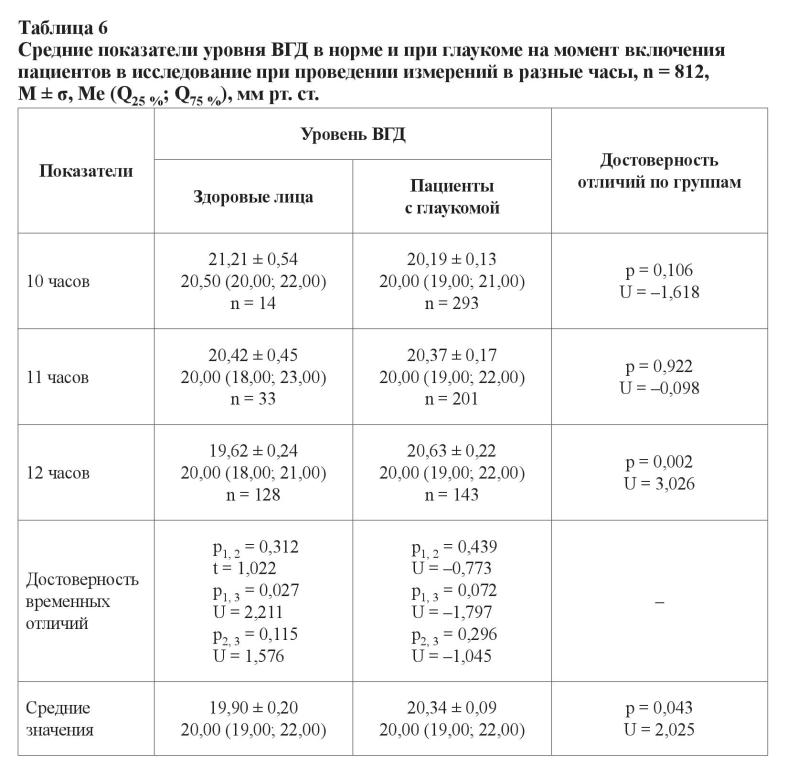
В возрастной группе от 60 до 69 лет уровень офтальмотонуса у лиц с далеко зашедшей стадией глаукомы был статистически достоверно выше, чем у больных с развитой стадией заболевания (p2, 3 = 0,002; U = –3,090) и у здоровых лиц (p0, 3 < 0,001; U = –3,547). При изучении данных других возрастных групп (между собой и в пределах одной стадии) таких различий установлено не было, что может быть свидетельством более быстрого прогрессирования заболевания именно в его начале. Подобные результаты ранее были продемонстрированы при изучении прогрессирования глаукомы у лиц с начальной стадией заболевания [22].
У здоровых лиц отмечалась тенденция к повышению уровня ВГД при измерении в интервале от 10 до 12 часов (p1, 3 = 0,027; U = 2,211). В это же время у пациентов с глаукомой было выявлено статистически недостоверное понижение уровня офтальмотонуса, что может быть объяснено действием препаратов, инстиллированных в утренние часы, либо циркадными ритмами (в случае, если инстилляция проводилась вечером накануне), p > 0,05. При сравнении показателей ВГД у здоровых лиц и больных глаукомой достоверные отличия были обнаружены по состоянию на 12:00 часов (19,62 ± 0,24 и 20,63 ± 0,22 мм рт. ст. соответственно, p = 0,002; U = 3,026).
В данное исследование были специально включены лица с одинаковой (средней) ЦТР. Поскольку в работе были использованы разные типы пахиметров, с целью исключения системной ошибки мы сравнили полученные с помощью разных приборов данные показателя ЦТР. Результаты представлены в таблице 7.
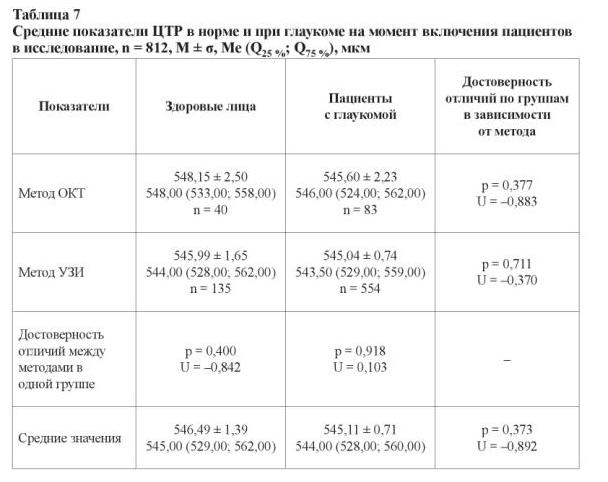
Оба метода измерений показали сопоставимые результаты (p = 0,373; U = –0,892). Для здоровых мужчин показатель ЦТР составил 546,65 ± 2,34 мкм (546,00 (528,00; 563,00)), для женщин – 546,39 ± 1,73 мкм (544,00 (531,00; 561,00)), p = 0,991 и U = –0,842. У больных глаукомой лиц мужского пола показатель ЦТР был 544,26 ± 1,22 мкм (542,00 (528,00; 558,00)), у женщин – 545,51 ± 0,87 мкм (544,00 (529,00; 560,00)), p = 0,501 и U = –0,673. Статистически достоверных различий не было обнаружено и при изучении этого показателя между здоровыми и больными глаукомой лицами женского и мужского пола соответственно (p > 0,05). Для пациентов с развитой стадией глаукомы показатель ЦТР составил 545,58 ± 0,87 мкм (544,00 (529,00; 560,00)), для больных с далеко зашедшей стадией – 544,14 ± 1,23 мкм (543,00 (527,00; 558,50)), p2, 3 = 0,344 и U = 0,946. Отсутствие различий в показателе ЦТР при использовании разных физических методов измерения позволило произвести измерение этого показателя при исследовании в разных возрастных группах пациентов с глаукомой (таблица 8).
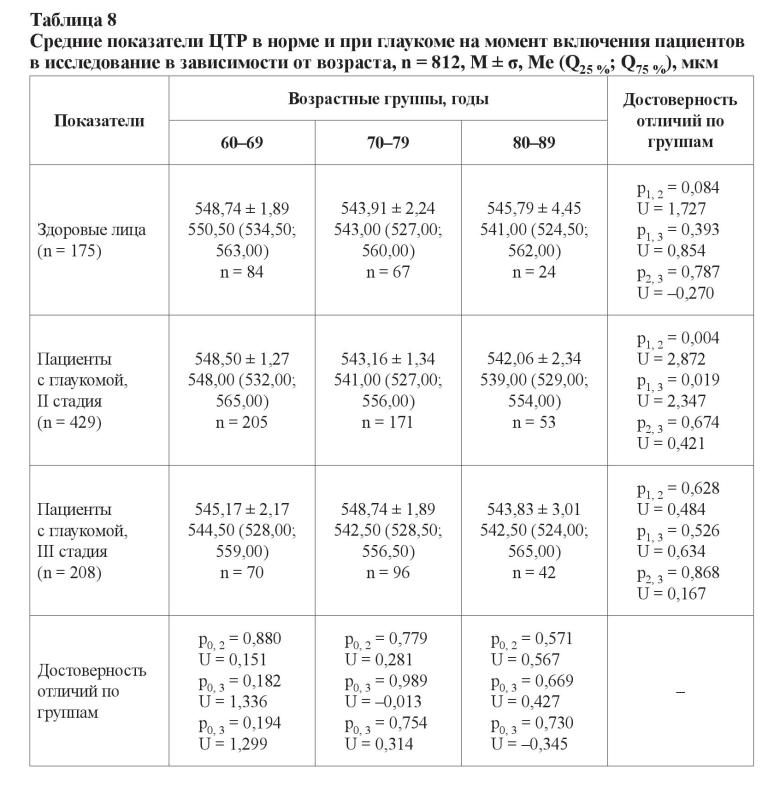
В возрастных подгруппах здоровых лиц не было обнаружено статистически значимых изменений показателя ЦТР (p > 0,05), а пациенты c развитой стадией глаукомы в возрасте от 60 до 69 лет имели наиболее «толстую» роговицу в оптической зоне – 548,50 ± 1,27 мкм по сравнению с результатами больных с глаукомой в возрасте от 70 до 79 лет (p0, 2 = 0,004; U = 2,872) и от 80 до 89 лет (p1, 3 = 0,019; U = 2,347), что является свидетельством глаукомных изменений, выражающимся в корнеальном «ремоделировании». Кроме этого, по состоянию на момент включения в исследование уровень ВГД у пациентов с III стадией значительно превышал верхний предел рекомендованных значений, что подразумевает, что прогрессирование сопровождалось неэффективностью применяемого гипотензивного лечения. В соответствии с данными клинических рекомендаций об оптимальных границах офтальмотонуса для пациентов с развитой и далеко зашедшей стадиями глаукомы нами было произведено деление на две подгруппы: с компенсированными и субкомпенсированным уровнями ВГД (для больных с развитой стадией глаукомы максимальный порог офтальмотонуса был принят на уровне 21 мм рт. ст., для пациентов с далеко зашедшей стадией – 18 мм рт. ст.). Полученные результаты с учетом поправочного коэффициента средней ЦТР суммированы в таблице 9 [32].
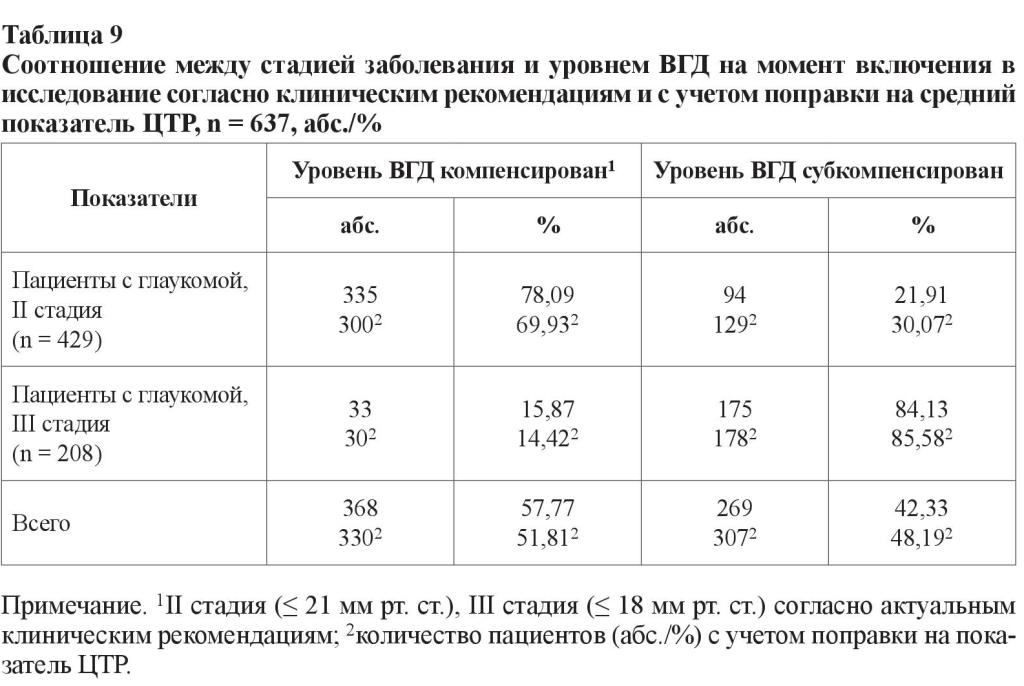
Доля пациентов с компенсацией уровня ВГД составила 78,09 и 15,87 % для развитой и далеко зашедшей стадий глаукомы соответственно. При пересчете этих показателей с учетом поправки на «стандартную» ЦТР, принятую за 545 мкм, доля пациентов с компенсацией уровня ВГД и II стадией уменьшилась на 8 % (до 69,93 %), с III стадией – на 1,5 % (до 14,42 %), в среднем уменьшившись на 6 %. Таким образом, только 51,81 % пациентов имели рекомендованный уровень офтальмотонуса. Не менее важным нам показались полученные результаты, в которых были отражены уровни офтальмотонуса, показатель ЦТР и группы препаратов, с помощью которых был достигнут этот уровень ВГД (таблица 10). Для наглядности сравнений в этой таблице приведены и данные здоровых лиц.
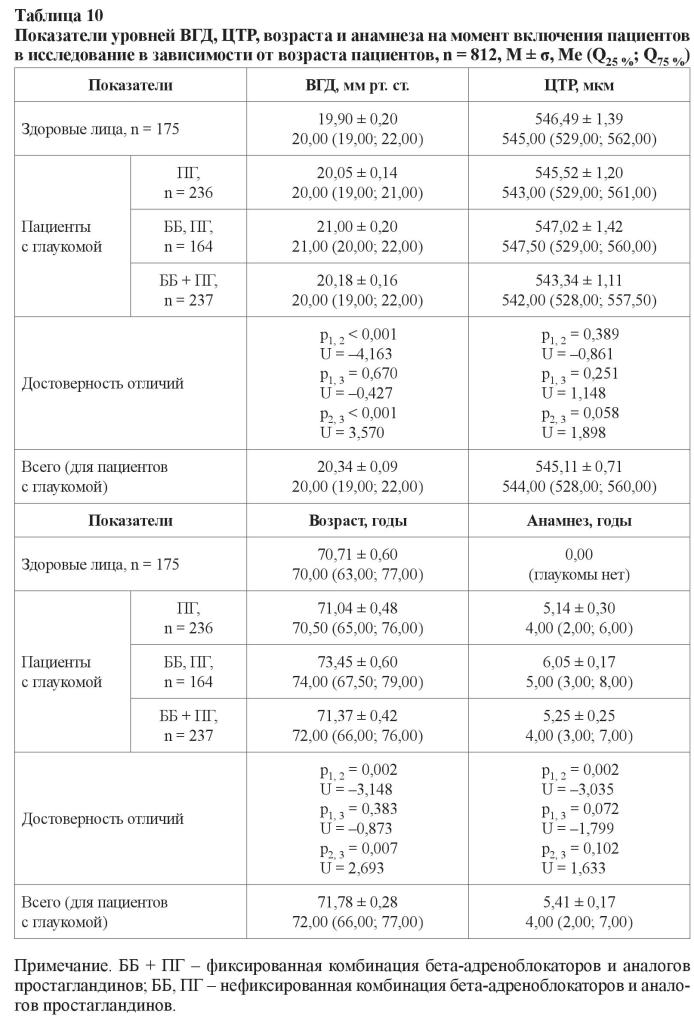
В отличие от показателей пациентов, которые получали монотерапию препаратами простагландинового ряда либо фиксированную комбинацию бета-адреноблокаторов и ПГ, для лиц, чей режим лечения состоял из нефиксированной комбинации ББ и ПГ, было характерно достоверно большее значение уровня ВГД (21,00 ± 0,20 мм рт. ст.), более длительный анамнез (6,05 ± 0,17 лет) и возраст пациентов (73,45 ± 0,60 лет). Анамнез заболевания у больных, получавших фиксированную и нефиксированную комбинации препаратов (5,25 ± 0,25 и 6,05 ± 0,17 лет соответственно), достоверно не различался. Нами также не было установлено различий в показателе ЦТР у лиц, получавших разные группы антиглаукомных гипотензивных препаратов. Вместе с тем у всех пациентов с III стадией глаукомы, вне зависимости от режима, уровень ВГД был выше, чем уровень офтальмотонуса у пациентов с развитой стадией болезни. Как при развитой, так и при далеко зашедшей стадии глаукомы не было установлено достоверных отличий в уровнях ВГД между режимами, которые были основаны на монотерапии препаратами простагландинового ряда и применении фиксированной комбинации ББ + ПГ. А уровень офтальмотонуса при использовании режима нефиксированной комбинации ББ и ПГ был выше вне зависимости от стадии глаукомы (таблица 11).
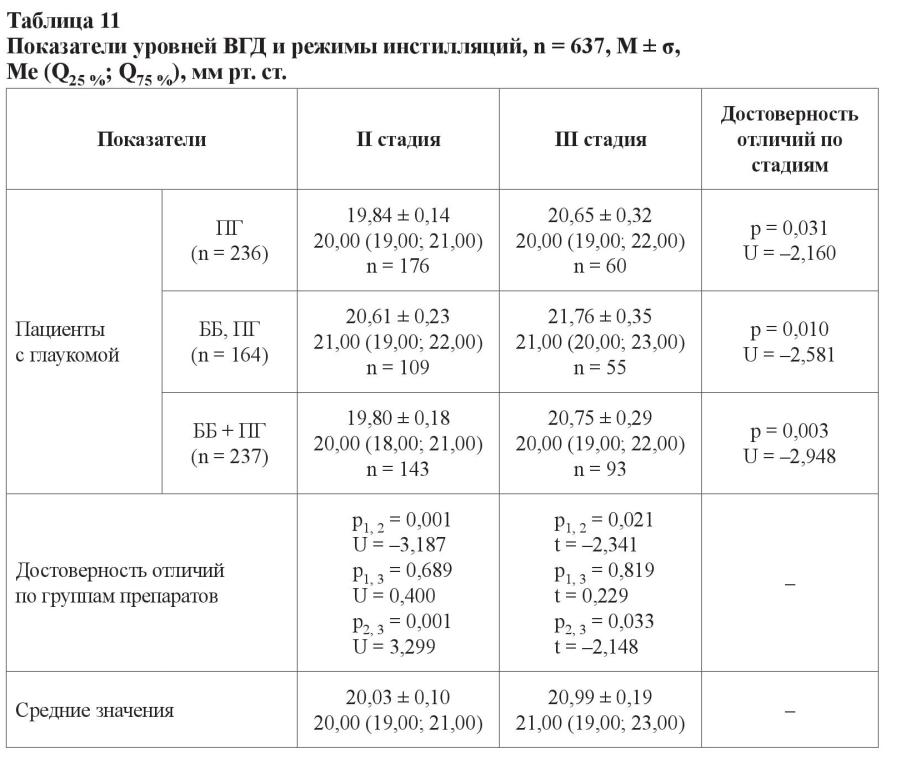
В таблице 12 указана установленная эффективность продолжительности сроков назначенных режимов инстилляций.
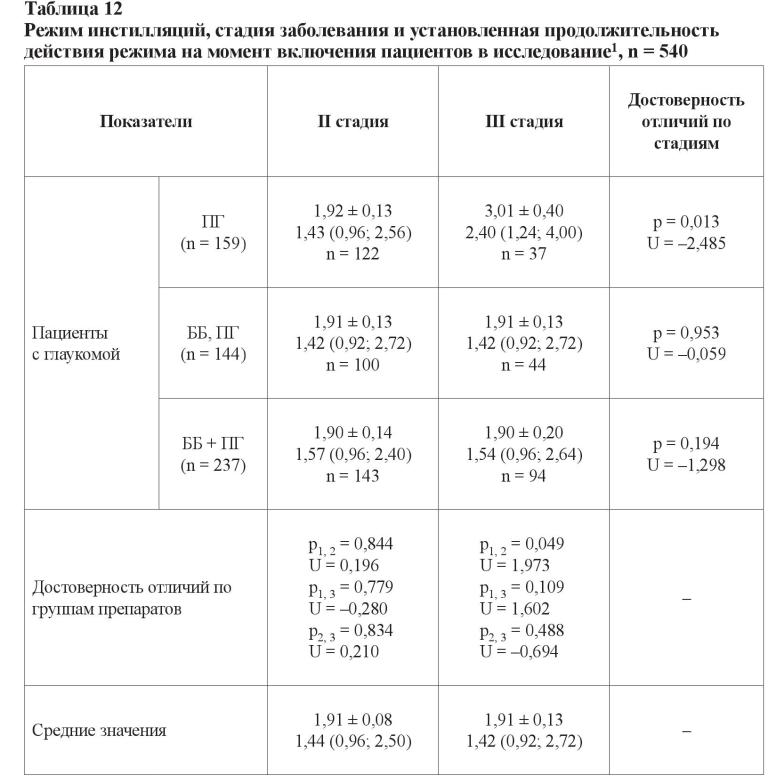
Общее количество пациентов с глаукомой, у которых режим инстилляционных назначений был изменен хотя бы один раз, составило 540 человек (540 глаз, 84,8 %). В 97 случаях наблюдений (15,2 %) он не менялся от момента первого назначения. Смена режима, по данным исследователей, была обусловлена неэффективностью лечения, и в целом эти данные соотносятся с результатами, приведенными в таблице 9. Длительность применения комбинированной терапии не отличалась независимо от стадии болезни (p = 0,953; U = –0,059 и p = 0,194; U = –1,298), составив в среднем менее 2-х лет. Пациенты со II стадией глаукомы использовали все режимы в течение одинакового промежутка времени, а больные с далеко зашедшей стадией могли дольше использовать режим инстилляций ПГ, чем комбинированную терапию.
ЗАКЛЮЧЕНИЕ
Показатели офтальмотонуса здоровых лиц и пациентов с развитой стадией глаукомы были сопоставимы и были ниже, чем у больных с далеко зашедшей стадией заболевания. Разница в уровнях офтальмотонуса между больными со II и III стадиями глаукомы составила 1 мм рт. ст. (p < 0,001, U = –4,485). В возрастной группе от 60 до 69 лет уровень ВГД у лиц с далеко зашедшей стадией глаукомы был статистически достоверно выше, чем у больных с развитой стадией заболевания и у здоровых лиц. В группе контроля обнаружена статистически значимая тенденция к повышению уровня ВГД при измерении в интервале между 10 и 12 часами (p = 0,027; U = 2,211). При изучении данных больных с глаукомой (между собой и в пределах одной стадии) таких различий установлено не было.
Целевые значения уровня ВГД у больных с развитой стадией глаукомы (≤ 21 мм рт. ст.) были достигнуты у 69,93 % пациентов, а значения ≤ 18 мм рт. ст. у 14,42 % больных с далеко зашедшей стадией. При этом в последнем случае средний уровень ВГД превышал рекомендованные оптимальные значения на 14,28 %. Таким образом, установлено, что только 51,81 % пациентов имели безопасные уровни ВГД, а стабилизация ГОН сохранялась на протяжении 3,60 ± 0,14 лет с переходом к следующей стадии через 7,13 ± 0,28 лет. Оба метода измерений ЦТР продемонстрировали сопоставимые результаты. Не было обнаружено различий и при изучении показателя ЦТР между здоровыми и больными глаукомой лицами женского и мужского пола, а также при сравнении данных пациентов с разными стадиями заболевания (545,58 ± 0,87 и 544,14 ± 1,23 мкм соответственно, p = 0,344 и U = 0,946). В пределах одной стадии пациенты c развитой стадией глаукомы в возрасте от 60 до 69 лет имели наиболее «толстую» роговицу по сравнению с результатами больных в возрасте от 70 до 79 и от 80 до 89 лет, что свидетельствует в пользу прогрессирующих корнеальных изменений при глаукоме.
Пациенты, включенные в исследование, использовали одну из трех схем инстилляций антиглаукомных препаратов, при этом достоверных различий в показателе ЦТР на фоне лечения обнаружено не было. При сопоставимом сроке анамнеза у лиц, которые получали комбинированное лечение, уровень офтальмотонуса был выше в той группе, которая получала нефиксированную комбинацию ББ и ПГ независимо от стадии глаукомы. Контролируемое понижение уровня ВГД при использовании схем комбинированной терапии составило в среднем менее 2-х лет.
Результаты данного исследования могут быть использованы с целью определения оптимальных границ офтальмотонуса, а также при выборе оптимального(ых) препарата(ов) на старте лечения и при динамическом наблюдении больных с развитой и далеко зашедшей стадиями глаукомы.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Авдеев Р. В. Факторы риска, патогенные факторы развития и прогрессирования по результатам многоцентрового исследования Российского глаукомного общества / Р. В. Авдеев, А. С. Александров, А. С. Басинский [и др.] // Мед.-биол. пробл. жизнедеятельности. – 2012. – № 2 (8). – С. 57–69.
- Авдеев Р. В. Клиническое многоцентровое исследование эффективности синусотрабекулэктомии / Р. В. Авдеев, А. С. Александров, А. С. Басинский [и др.] // Глаукома. – 2013. – № 2. – С. 53–60.
- Куроедов А. В. Клинико-экономические подходы в лечении больных глаукомой / А. В. Куроедов // Офтальмологические ведомости. – 2010. – № 1. – С. 51–62.
- Авдеев Р. В. Степень взаимного влияния и характеристики морфофункциональных взаимоотношений между первичной открытоугольной глаукомой и макулодистрофией / Р. В. Авдеев, А. С. Александров, А. С. Басинский [и др.] // Офтальмологические ведомости. – 2014. – № 1. – С. 19–27.
- Аветисов С. Э. Влияние центральной толщины роговицы на результаты тонометрии / С. Э. Аветисов, С. Ю. Петров, И. А. Бубнова [и др.] // Вестник офтальмологии. – 2008. – № 5. – С. 3–7.
- Аветисов С. Э. Результаты клинической оценки нового скринингового метода определения индивидуальной нормы внутриглазного давления / С. Э. Аветисов, В. Р. Мамиконян, Э. Э. Казарян [и др.] // Вестник офтальмологии. – 2010. – № 2. – С. 5–8.
- Алексеев В. Н. О распределении уровней внутриглазного давления в нормальной популяции / В. Н. Алексеев, Е. А. Егоров, Е. Б. Мартынова // Клиническая офтальмология. – 2001. – № 2. – С. 38–40.
- Алексеев В. Н. Взаимосвязь пахиметрических показателей и уровня офтальмотонуса среди здоровой популяции и больных первичной открытоугольной глаукомой / В. Н. Алексеев, И. Б. Литвин // Глаукома. – 2009. – № 4. – С. 17–20.
- Арутюнян Л. Л. Роль биомеханических свойств глаза в определении целевого давления / Л. Л. Арутюнян // Глаукома. – 2007. – № 3. – С. 60–67.
- Астахов Ю. С. Сравнительная характеристика современных методов тонометрии / Ю. С. Астахов, Е. Л. Акопов, В. В. Потемкин // Вестник офтальмологии. – 2008. – № 5. ‒ С. 11–4.
- Балалин С. В. К вопросу о толерантности и интолерантности зрительного нерва к внутриглазному давлению при глаукоме / С. В. Балалин, В. П. Фокин // Клиническая офтальмология. – 2009. – № 4. – С. 128–132.
- Бикбов М. М. Влияние толщины роговицы на показатели внутриглазного давления у больных глаукомой / М. М. Бикбов, А. Ф. Габдрахманова, О. И. Оренбуркина [и др.] // Вестник офтальмологии. – 2008. – № 5. – С. 7–10.
- Водовозов А. М. Толерантное и интолерантное внутриглазное давление при глаукоме / А. М. Водовозов. – Волгоград : БИ, 1991. – 160 с.
- Волков В. В. Глаукома, преглаукома, офтальмогипертензия / В. В. Волков, Л. Б. Сухинина, Е. И. Устинова. – Ленинград : Медицина, 1985. – 216 с.
- Егоров Е. А. Влияние толщины роговицы на уровень внутриглазного давления среди различных групп пациентов / Е. А. Егоров, М. В. Васина // Клиническая офтальмология. – 2006. – № 1. – С. 16–19.
- Егоров Е. А. Отдельные клинико-эпидемиологические характеристики глаукомы в странах СНГ и Грузии. Результаты многоцентрового открытого ретроспективного исследования (часть 1) / Е. А. Егоров, А. В. Куроедов // Клиническая офтальмология. – 2011. – № 3. – С. 97–100.
- Егоров Е. А. Отдельные клинико-эпидемиологические характеристики глаукомы в странах СНГ и Грузии. Результаты многоцентрового открытого ретроспективного исследования (часть 2) / Е. А. Егоров, А. В. Куроедов // РМЖ. Клиническая офтальмология. – 2012. – № 1. – С. 19–22.
- Еремина М. В. Влияние центральной толщины роговицы на уровень внутриглазного давления в норме и при глаукоме / М. В. Еремина, В. П. Еричев, Л. В. Якубова // Глаукома. – 2006. – № 4. – С. 78–83.
- Еремина М. В. Биомеханические свойства роговицы при первичной открытоугольной глаукоме / М. В. Еремина // Вестник офтальмологии. – 2008. – № 5. – С. 16–19.
- Зайко Н. Н. Внутриглазное давление и его регуляция / Н. Н. Зайко, С. М. Минц. – Киев : Здоровье, 1966. – 296 с.
- Катаргина Л. А. Значение центральной толщины роговицы в прогрессировании первичной открытоугольной глаукомы / Л. А. Катаргина, О. А. Киселева, Л. Л. Арутюнян [и др.] // Новости глаукомы. – 2010. – № 1. – С. 3–5.
- Козлова Л. П. Характеристика течения I стадии открытоугольной глаукомы / Л. П. Козлова, Н. А. Спорова, С. А. Леонов // Вестник офтальмологии. – 1983. – № 2. – С. 14–15.
- Куроедов А. В. Центральная толщина роговицы как фактор риска прогрессирования первичной открытоугольной глаукомы / А. В. Куроедов, В. В. Городничий // Глаукома. – 2008. – № 4. – С. 20–28.
- Нероев В. В. Основные результаты мультицентрового исследования эпидемиологических особенностей первичной открытоугольной глаукомы в Российской Федерации / В. В. Нероев, О. А. Киселева, А. М. Бессмертный // Росcийский офтальмологический журнал. – 2013. – № 3. – С. 4–7.
- Нестеров А. П. О патогенезе глаукоматозной атрофии зрительного нерва / А. П. Нестеров, Е. А. Егоров // Офтальмологический журнал. – 1979. – № 7. – С. 419–422.
- Нестеров А. П. Глаукомная оптическая нейропатия / А. П. Нестеров // Вестник офтальмологии. – 1999. – № 4. – С. 3–6.
- Панина Н. Б. О нормах внутриглазного давления / Н. Б. Панина // Глаукома и другие заболевания глаз. – Ленинград, 1971. – С. 7–12.
- Файзрахманов Р. Р. Индивидуальная зависимость внутриглазного давления от толщины роговицы в норме / Р. Р. Файзрахманов, Н. А. Собянин, А. А. Волков [и др.] // Глаукома. – 2001. – № 3. – С. 3–6.
- Doughty M. J. Human corneal thickness and its impact on intraocular pressure measures: a review: a meta-analysis approach / M. J. Doughty, M. L. Zaman // Survey of Ophthalmology. – 2000. – Vol. 44. – No. 5. – P. 367–408.
- Ehlers N. Applanation tonometry and central corneal thickness / N. Ehlers, T. Bramsen, S. Sperling // Acta Ophthalmologica (Copenhagen). – 1975. – Vol. 53. – No. 1. – Р. 34–43.
- Gordon M. O. The Ocular Hypertension Treatment Study: baseline factors that predict the onset of primary open angle glaucoma / M. O. Gordon, J. A. Beiser, J. D. Brandt, [et al.] // Archives of Ophthalmology. – 2002. – Vol. 120. – No. 6. – P. 714–720.
- Herndon L. W. Rethinking pachymetry and intraocular pressure / L. W. Herndon, D. A. Lee, P. A. Netland // Review of Ophthalmology. – 2002. – Vol. 2. – No. 1. – P. 88–90.
- Realini T. Frequency of asymmetric intraocular pressure fluctuations among patients with and without glaucoma / T. Realini, L. Barber, D. Burton // Ophthalmology. – 2002. – Vol. 109. – No. 7. – P. 1367–1371.
- Shah S. Relationship between corneal thickness and measurement intraocular pressure in general ophthalmology clinic / S. Shah, A. Chatterjee, M. Mathai, [et al.] // Ophthalmology. – 1999. – Vol. 106. – No. 11. – P. 2154–2160.
- Varma R. Inter-visit intraocular pressure range: an alternative parameter for assessing intraocular pressure control in clinical trials / R. Varma, L.-J. Hwang, J. W. Grunden, [et al.] // American Journal of Ophthalmology. – 2008. – Vol. 145. – No. 2. – P. 336–342.
- Whitacre M. M. The effect of corneal thickness in applanation tonometry / M. M. Whitacre, R. A. Stein, K. Hassanein // American Journal of Ophthalmology. – 1993. – Vol. 115. – No. 5. – P. 592–596.
REFERENCES
- Avdeev R. V., Aleksandrov A. S., Basinskiy A. S., et al. Risk factors, pathogenic factors of development and progression of the results of a multicenter study of Russian society glaucoma. Mediko-biologicheskie problemy zhiznedeyatelnosti [Medical and biological problems of vital functions]. 2012; (2): 57–69 (in Russian).
- Avdeev R. V., Aleksandrov A. S., Basinskiy A. S., et al. Clinical multicenter study of the effectiveness of trabeculectomy. Glaukoma [Glaucoma]. 2013; (2): 53–60 (in Russian).
- Kuroedov A. V. Clinical and economic approaches in the treatment of patients with glaucoma. Oftalmologicheskie vedomosti [Ophthalmological journal]. 2010; (1): 51–62 (in Russian).
- Avdeev R. V., Aleksandrov A. S., Basinskiy A. S., et al. The degree of mutual influence and the relationship between morphological and functional characteristics of primary open-angle glaucoma and macular degeneration. Oftalmologicheskie vedomosti [Ophthalmic statements]. 2014; (1): 19–27 (in Russian).
- Avetisov S. E., Petrov S. Yu., Bubnova I. A., et al. Influence of central corneal thickness on the tonometry results. Vestnik oftalmologii [Bulletin of ophthalmology]. 2008; (5): 3–7 (in Russian).
- Avetisov S. E., Mamikonyan V. R., Kazaryan E. E., Shmeleva-Demir O. A. The results of the clinical evaluation of a new screening method for determining an individual rate of intraocular pressure. Vestnik oftalmologii [Bulletin of ophthalmology]. 2010; (2): 5–8 (in Russian).
- Alekseev V. N., Egorov E. A., Martynova E. B. Intraocular pressure levels distribution in normal population. RMZh. Klinicheskaya Oftalmologiya [RMJ. Clinical ophthalmology]. 2001; (2): 38–40 (in Russian).
- Alekseev V. N., Litvin I. B. The relationship of pachymetric indicators and the level of IOP among the healthy population and patients with primary open-angle glaucoma. Glaukoma [Glaucoma]. 2009; (4): 17–20 (in Russian).
- Arutyunyan L. L. The role of the biomechanical properties of the eye in determining the target pressure. Glaukoma [Glaucoma]. 2007; (3): 60–67 (in Russian).
- Astakhov Yu. S., Akopov E. L., Potemkin V. V. Comparative characteristics of modern methods of tonometry. Vestnik oftalmologii [Bulletin of ophthalmology]. 2008; (5): 11–14 (in Russian).
- Balalin S. V., Fokin V. P. On the issue of tolerance and intolerance to the optic nerve inside the eye pressure in glaucoma. RMZh. Klinicheskaya Oftalmologiya [RMJ. Clinical ophthalmology]. 2009; (4): 128–132 (in Russian).
- Bikbov M. M., Gabdrakhmanova A. F., Orenburkina O. I., et al. Influence of corneal thickness on the performance of intraocular pressure in patients with glaucoma. Vestnik oftalmologii [Bulletin of ophthalmology]. 2008; (5): 7–10 (in Russian).
- Vodovozov A. M. Tolerance and intolerance intraocular pressure in glaucoma. Volgograd, BI, 1991, 160 p. (in Russian).
- Volkov V. V., Sukhinina L. B., Ustinova E. I. Glaucoma, preglaukoma, ophthalmohypertension. Leningrad, Meditsina, 1985, 216 p. (in Russian).
- Egorov E. A., Vasina M. V. Influence of corneal thickness on intraocular pressure levels among different groups of patients. RMZh. Klinicheskaya Oftalmologiya [RMJ. Clinical ophthalmology]. 2006; (1): 16–19 (in Russian).
- Egorov E. A., Kuroyedov A. V. Individual clinical and epidemiological characteristics of glaucoma in CIS countries and Georgia. Results of a multicenter open retrospective study (part 1). RMZh. Klinicheskaya Oftalmologiya [RMJ. Clinical ophthalmology]. 2011; (3): 97–100 (in Russian).
- Egorov E. A., Kuroyedov A. V. Clinical and epidemiological characteristics of glaucoma in CIS and Georgia. Results of multicenter opened retrospective trial (part 2). RMZh. Klinicheskaya oftalmologiya [RMJ. Clinical ophthalmology]. 2012; (1): 19–22 (in Russian).
- Eremina M. V., Erichev V. P., Yakubova L. V. Effect of the central corneal thickness to the level of intraocular pressure in normal and glaucomatous. Glaukoma [Glaucoma]. 2006; (4): 78–83 (in Russian).
- Eremina M. V. Biomechanical properties of the cornea in primary open-angle glaucoma. Vestnik oftalmologii [Bulletin of ophthalmology]. 2008; (5): 16–19 (in Russian).
- Zayko N. N., Mints S. M. Intraocular pressure and its regulation. Kyiv, Zdorovie, 1966, 296 p. (in Russian).
- Katargina L. A., Kiseleva O. A., Arutyunyan L. L., Filippova O. M. The value of central corneal thickness in the progression of primary open-angle glaucoma. Novosti glaukomy [Glaucoma news]. 2010; (1): 3–5 (in Russian).
- Kozlova L. P., Sporova N. A., Leonov S. A. Characteristics of the course and I stage of openangle glaucoma. Vestnik oftalmologii [Bulletin of ophthalmology]. 1983; (2): 14–15 (in Russian).
- Kuroyedov A. V., Gorodnichiy V. V. Central corneal thickness as a risk factor for the progression of primary open-angle glaucoma. Glaukoma [Glaucoma]. 2008; (4): 20–28 (in Russian).
- Neroev V. V., Kiseleva O. A., Bessmertnyy A. M. The main results of a multicenter study of epidemiological characteristics of primary open-angle glaucoma in the Russian Federation. Rossiyskiy oftalmologicheskiy zhurnal [Russian ophthalmological journal]. 2013; (3): 4–7 (in Russian).
- Nesterov A. P., Egorov E. A. On the pathogenesis of glaucomatous optic nerve atrophy. Oftalmologicheskiy zhurnal [Journal of ophthalmology]. 1979; (7): 419–422 (in Russian).
- Nesterov A. P. Glaucomous optic neuropathy. Vestnik oftalmologii [Bulletin of ophthalmology]. 1999; (4): 3–6 (in Russian).
- Panina N. B. Norms of intraocular pressure. In: Glaucoma and other eye diseases. Leningrad, 1971, pp. 7–12 (in Russian).
- Fayzrakhmanov R. R., Sobyanin N. A., Volkov A. A., Fayzrakhmanova O. A. Individual dependence of intraocular pressure in normal corneal thickness. Glaukoma [Glaucoma]. 2001; (3): 3–6 (in Russian).
- Doughty M. J., Zaman M. L. Human corneal thickness and its impact on intraocular pressure measures: a review: a meta-analysis approach. Survey of Ophthalmology. 2000; 44(5): 367–408.
- Ehlers N., Bramsen T., Sperling S. Applanation tonometry and central corneal thickness. Acta Ophthalmologica (Copenhagen). 1975; 53(1): 34–43.
- Gordon M. O., Beiser J. A., Brandt J. D., et al. The Ocular Hypertension Treatment Study: baseline factors that predict the onset of primary open angle glaucoma. Archives of Ophthalmology. 2002; 120(6): 714–720.
- Herndon L. W., Lee D. A., Netland P. A. Rethinking pachymetry and intraocular pressure. Review of Ophthalmology. 2002; 2(1): 88–90.
- Realini T., Barber L., Burton D. Frequency of asymmetric intraocular pressure fluctuations among patients with and without glaucoma. Ophthalmology. 2002; 109(7): 1367–1371.
- Shah S., Chatterjee A., Mathai M., et al. Relationship between corneal thickness and measurement intraocular pressure in general ophthalmology clinic. Ophthalmology. 1999; 106(11): 2154–2160.
- Varma R., Hwang L.-J., Grunden J. W., Bean G. W. Inter-visit intraocular pressure range: an alternative parameter for assessing intraocular pressure control in clinical trials. American Journal of Ophthalmology. 2008; 145(2): 336–342.
- Whitacre M. M., Stein R. A., Hassanein K. The effect of corneal thickness in applanation tonometry. American Journal of Ophthalmology. 1993; 115(5): 592–596.
Стаття надійшла в редакцію 07.04.2016 р.
Рецензія на статтю надійшла в редакцію 20.04.2016 р.