- Автор: Super User
- Категорія: Український журнал «Офтальмологія» № 1 (11) 2020
- Опубліковано: 07 грудня 2020
- Перегляди: 2187
https://doi.org/10.30702/Ophthalmology30092020-11.1.2049-65
УДК 617.7-007.681-053.1-089.843
Боброва Н. Ф., д-р мед. наук, профессор, зав. отделом офтальмопатологии детского возраста
Трофимова Н. Б., канд. мед. наук, врач-офтальмолог отдела офтальмопатологии детского возраста
ГУ «Институт глазных болезней и тканевой терапии им. В. П. Филатова НАМН Украины», г. Одесса, Украина
Резюме. Целью работы было проанализировать отдаленные результаты использования временного «жидкого» имплантата в хирургии врожденной глаукомы у детей.
В основу разработанного способа антиглаукоматозной операции фильтрующего типа (Патент Украины № 45099 от 2009 года) – вискосинусотрабекулотомии – поставлена задача снижения риска развития интра- и послеоперационных осложнений, снижения интенсивности рубцевания и сохранения вновь созданных путей оттока внутриглазной жидкости, что в целом позволит повысить эффективность хирургического лечения врожденной глаукомы у детей.
Прооперировано 54 ребенка (91 глаз) с простой врожденной глаукомой в возрасте от 1 до 36 мес., в среднем 8,7 ± 8,2 месяца.
Достигнутый вследствие вискосинусотрабекулотомии стойкий и длительный гипотензивный эффект у детей на глазах с развитой и далекозашедшей стадиями врожденной глаукомы останавливает процессы растяжения оболочек глаза и стабилизирует их размеры, что в целом позволяет сохранить и улучшить зрительные функции, а в младенческом возрасте – создать условия для их формирования.
Ключевые слова: врожденная глаукома, временный «жидкий» имплантат, вискосинусотрабекулотомия.
Bobrova N. F., Trofimova N. B.
The Filatov Institute of Eye Diseases and Tissue Therapy of the National Academy of Medical Sciences of Ukraine, Odesa, Ukraine
Temporary “liquid” Implant for Congenital Glaucoma (long-term results)
Abstract
The aim of the work was to analyze the long-term results of using a temporary “liquid” implant in the surgery of congenital glaucoma in children.
The basis of the developed method of filtrative antiglaucomatous surgery (Patent of Ukraine No. 45099 of 2009) – viscosinusotrabeculotomy – has been set the task of reducing the risk of developing intra- and postoperative complications, reducing the scarring rate and maintaining the newly created ways of the intraocular fluid outflow, which in general will increase the effectiveness of surgical treatment of congenital glaucoma in children.
54 children (91 eyes) with simple congenital glaucoma at the age of 1 to 36 months were operated on average (8.7 ± 8.2) months.
The persistent and long-lasting hypotensive effect achieved due to viscosinusotrabeculotomy in children with developed and far-advanced stages of congenital glaucoma stops the processes of stretching of the membranes of the eye and stabilizes their size, which in general allows preserving and visual functions improving, in infancy – creating conditions for their formation.
Keywords: congenital glaucoma, temporary “liquid” implant, viscosinusotrabeculotomy.
Врожденная глаукома – одна из тяжелых патологий глаз в детском возрасте, которая была известна древней медицине и упоминалась Гиппократом и Цельсием как заболевание с врожденным увеличением глаз и последующей необратимой слепотой. Встречается относительно редко (1 случай на 10–20 тыс. новорожденных). Особенностью, отличающей врожденную глаукому от глаукомы взрослых, является эластичность и растяжимость тканей глаза ребенка, в связи с чем повышение внутриглазного давления (ВГД) в первые годы жизни может привести к буфтальму – увеличению глазного яблока за счет истончения его оболочек (роговицы, склеры) [1, 18, 22, 23, 28, 36, 39, 45].
Несмотря на достаточно редкую встречаемость, врожденная глаукома чаще, чем другие глазные болезни приводит к ранней слепоте и инвалидизации детей, особенно первых лет жизни [1, 22, 23, 36]. Основой профилактики слепоты при врожденной глаукоме является ее ранняя диагностика и своевременное лечение. В настоящее время лечение детей, страдающих врожденной глаукомой, несмотря на определенные достижения в этой области, остается одной из наиболее трудных проблем детской офтальмологии. Медикаментозная терапия малоэффективна и, как правило, служит дополнением к оперативному вмешательству [3, 11, 18, 30, 33, 40, 51]. Основной и эффективный способ лечения врожденной глаукомы – хирургический.
Избыточное рубцевание в зоне сформированных путей оттока внутриглазной жидкости – одна из ведущих причин снижения эффективности антиглаукоматозных операций, которая, по данным различных авторов, может снижаться до 35–65 % в отдаленные сроки наблюдения [4, 7, 13–16, 24, 25].
Цель
Проанализировать отдаленные результаты использования временного «жидкого» имплантата в хирургии врожденной глаукомы у детей.
Материалы и методы
В основу разработанного нами способа антиглаукоматозной операции фильтрующего типа (Патент Украины № 45099 от 2009 года) [21] – козырьковой вискосинусотрабекулотомии поставлена задача снижения риска развития интра- и послеоперационных осложнений, снижения интенсивности рубцевания и сохранения вновь созданных путей оттока внутриглазной жидкости, что в целом позволит повысить эффективность хирургического лечения врожденной глаукомы у детей.
Особенностью разработанного способа является введение дисперсионного вискоэластика, содержащего гиалуроновую кислоту в зону вновь сформированных путей оттока внутриглазной жидкости, что приводит к разобщению раневых поверхностей склеральных лоскутов и снижению интенсивности воспалительного ответа травмированных тканей, поддержанию и сохранению объема вновь созданных фильтрационных путей, выполняя функцию временного «жидкого» имплантата.
Основные этапы нового способа фильтрующей антиглаукоматозной операции – козырьковой вискосинусотрабекулотомии:
– разрез конъюнктивы и теноновой оболочки соответственно 12 часам параллельно лимбу в 5 мм от него с отсепаровкой в сторону лимба;
– выкраивание поверхностного склерального лоскута трапециевидной формы на 2/3 толщины склеры основанием к лимбу шириной около 8 мм и длиной до 5 мм (рисунок 1). При достижении разреза роговично-склеральной области, имеющей серовато-голубой оттенок, кзади от нее становится видна белая линия склеральной шпоры, расслоение проводиться до прозрачной части роговицы, что дает уверенность в том, что дальнейшие манипуляции будут проводиться в области дренажной зоны, а не над цилиарным телом;
– локализация шлеммова канала, ориентиром которого при расслоении склеры ближе к лимбу является белесая полоска склеральной шпоры, кпереди от которой локализуется его просвет;
– накладывание провизорного шва на вершину склерального лоскута;
– введение в переднюю камеру через боковой парацентез в зону операции дисперсионного вискоэластика, содержащего гиалуроновую кислоту (рисунок 2);
– нанесение 2 надрезов глубоких слоев склеры перпендикулярно лимбу до вскрытия передней камеры длиной около 1 мм;
– осуществление этапа вискосинусотрабекулотомии путем введения бранши микроножниц в переднюю камеру через один из перпендикулярных лимбу надрезов глубоких слоев склеры с последующим соединением двух надрезов в косом направлении, производя одновременное рассечение всех структур угла передней камеры (мезодермальной ткани, трабекулярной зоны, передней и задней стенок шлеммова канала), с образованием «козырька» глубоких слоев склеры (рисунок 3);
– шовная фиксация поверхностного лоскута склеры на прежнее место (рисунок 4);
– дополнительное введение вискоэластика между поверхностным и глубоким лоскутами склеры, а также между склерой, теноновой оболочкой и конъюнктивой в зоне операции (рисунок 5);
– наложение непрерывного конъюнктивального шва.
Всем детям детальное офтальмологическое обследование проводилось в условиях общей анестезии до и после операции (через 3, 6, 9, 12, 24, 36 месяцев): биомикро- и офтальмоскопия, тонометрия по Маклакову, электронная тонография, УЗ-биометрия, пахиметрия, сканирование, гониоскопия, острота зрения определялась по оптотипам Теллера. В послеоперационном периоде оценка состояния сформированных путей оттока определялась методом ультразвуковой биомикроскопии (УБМ).
Прооперировано 54 ребенка (91 глаз) с простой врожденной глаукомой в возрасте от 1 до 36 месяцев, в среднем 8,7 ± 8,2 месяца. Дооперационный уровень ВГД был повышен от 23 до 49 мм рт. ст., в среднем 31,9 ± 4,5 мм рт. ст. Гидродинамика глаз была резко нарушена за счет уменьшения коэффициента легкости оттока. Превалировала – 62 глаза (68,1 %) – далекозашедшая стадия простой врожденной глаукомы.
Диаметр роговицы превышал возрастную норму и колебался от 12 до 16,5 мм. На 73 глазах отмечены отек и диффузные помутнения роговицы. По данным ультразвуковой пахиметрии толщина роговицы варьировала от 0,433 мм до 0,994 мм, в среднем – 0,607 ± 0,147 мм, что было обусловлено ее отеком.
Переднезадний размер глаза значительно превышал возрастные показатели и варьировал от 20,0 до 30,2 мм, в среднем 24,3 ± 1,7 мм.
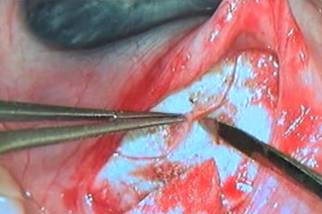
Рисунок 1. Формирование лоскута из поверхностных слоев склеры на 2/3 толщины основанием к лимбу
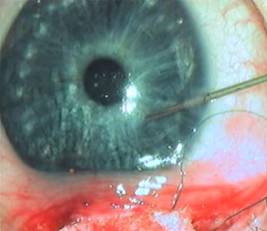
Рисунок 2. Введение дисперсионного вискоэластика в переднюю камеру через боковой парацентез
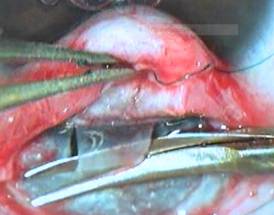
Рисунок 3. Осуществление этапа вискосинусотрабекулотомии микроножницами с формированием «козырька» из глубоких слоев склеры со свободным выходом вискоэластика из передней камеры в зону вмешательства
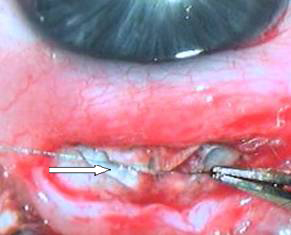
Рисунок 4. Шовная фиксация поверхностного склерального лоскута на прежнее место (вискоэластик, выходящий изпод поверхностного склерального лоскута, указан стрелкой)
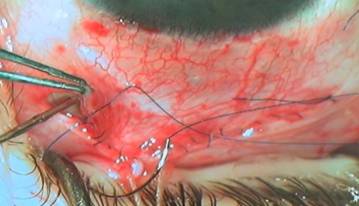
Рисунок 5. Дополнительное введение вискоэластика между склерой и конъюнктивой в зоне операции дает возможность сформировать фильтрационную подушку на операционном столе. Наложение непрерывного конъюнктивального шва
Острота зрения при поступлении была резко снижена: в 29,3 % до светоощущения, в 42,7 % определялось форменное зрение, в 28 % колебалась от 0,01 до 0,13.
При гониоскопии в большинстве случав (66 %) выявлялся гониодисгенез II–III степени с наличием мезодермальной ткани в углу передней камеры, в 16 % выявлены гониосинехии.
Глубина экскавации диска зрительного нерва колебалась от 0,2 мм до 1,9 мм и в среднем составила 0,82 ± 0,33 мм.
Результаты
Оперативное вмешательство по разработанной методике имело преимущественно неосложненное течение. На 75 глазах при переднем прикреплении радужки операция была дополнена базальной иридэктомией. Использование вискоэластика оказывало положительное влияние на ход операции: позволяло сохранять стабильность глубины передней камеры, устраняло резкий перепад ВГД, препятствовало выпадению радужки в операционный разрез и развитию гемморагических осложнений, способствовало поддержанию объема сформированного пространства, снижению интенсивности воспалительного ответа травмированных тканей. Во всех случаях удалось сформировать дополнительные пути оттока внутриглазной жидкости c формированием разлитой фильтрационной подушечки.
При контрольном обследовании через 3 месяца на 90 глазах (98,9 %) ВГД компенсировано – от 14 до 23 мм рт. ст., в среднем 18,3 ± 2,9 мм рт. ст., на 1 глазу – с дополнительным назначением гипотензивных капель. Отек роговицы купирован, переднезадняя ось глаза уменьшилась в среднем до 22,9 ± 1,2 мм. Клинически во всех случаях определялось наличие разлитой фильтрационной подушечки. Дополнительная оценка состояния новообразованных путей оттока внутриглазной жидкости проводилась с помощью УБМ, которая позволила в различные сроки после оперативного вмешательства изучить акустическую морфологию дренажного пути, определить наличие интрасклерального пространства, заполненного внутриглазной жидкостью и сообщение его с передней камерой. При проведении гониоскопии выявлялось наличие фильтрационной щели в зоне оперативного вмешательства.
Через 1 год после оперативного вмешательства нормальное ВГД достигнуто в 94,4 % случаев и в среднем составило 18,9 ± 2,2 мм рт. ст. На двух глазах в связи с неполной компенсацией ВГД возникла необходимость в дополнительном назначении гипотензивных капель.
В отдаленные сроки наблюдения через 2 и 3 года стойкий гипотензивный эффект достигнут в 94 % и 90 % случаев, ВГД в среднем составило 18,7 ± 1,9 мм рт. ст. и 19,1 ± 1,3 мм рт. ст. Ни в одном случае для компенсации ВГД не потребовалось проведение повторных оперативных вмешательств.
Эффективность оперативного вмешательства проиллюстрирована в следующем клиническом примере.
Ребенок К. в возрасте 3 месяцев поступил в детское отделение ГУ «Институт глазных болезней и тканевой терапии им. В. П. Филатова НАМН Украины» с жалобами на слезотечение, светобоязнь, беспокойное поведение ребенка, помутнение роговицы и визуальное увеличение левого глаза в размере (рисунок 6). Вышеуказанные симптомы родители отмечали с первых недель жизни ребенка. При поступлении наблюдаются светобоязнь, слезотечение, буфтальм слева. Роговица левого глаза диффузно отечна, увеличена в размере – до 14 мм в диаметре. Передняя камера глубокая, влага прозрачная. Зрачок круглый, около 3 мм, в центре, подвижный. Рефлекс с глазного дна – розовый, ослаблен, детальная офтальмоскопия и гониоскопия затруднена из-за состояния роговицы. Острота зрения левого глаза снижена до светоощущения. ВГД правого глаза (OD) = 17 мм рт. ст., левого (ОS) = 34 мм рт. ст., тонографию провести не удалось из-за высоких показателей ВГД. ПЗО OD = 18,9 мм, OS = 23 мм; глубина передней камеры OS превышала возрастную норму и составила 4 мм. При сканировании заднего отдела ОS – отмечается экскавация диска зрительного нерва (ДЗН) глубиной 1,2 мм.

Рисунок 6. Ребенок К. в возрасте 3 месяцев с односторонней врожденной простой далекозашедшей глаукомой слева: диффузный отек, увеличение роговицы левого глаза в диаметре: ОD = 10,5 мм, OS = 14 мм. Острота зрения снижена до светоощущения. ВГД OD = 17 мм рт. ст., OS = 34 мм рт. ст. Глубина передней камеры OD = 2,5 мм; OS = 4 мм. ПЗО OD = 18,9 мм, OS = 23 мм
Диагноз: правый глаз – здоров. Левый глаз – врожденная простая далекозашедшая глаукома, буфтальм, отек роговицы.
На левом глазу (в 3-месячном возрасте) было проведено оперативное вмешательство по разработанной методике. Операция и послеоперационный период протекали спокойно, геморрагических и воспалительных осложнений не наблюдалось. В раннем послеоперационном периоде поведение ребенка стабилизировалось, явления отека роговицы и слезотечение значительно уменьшились. В первые дни сформировалась высокая фильтрационная подушечка, которая несколько уплостилась к выписке.
При контрольном осмотре через 6 месяцев после оперативного лечения (рисунок 7): диаметр роговицы OS уменьшился до 13,5 мм, прозрачность роговицы восстановилась, явлений отека роговицы не обнаружено. ВГД компенсировано до 18 мм рт. ст. Тонография: ОD Ро – 15,0; С – 0,26; коэффициент Беккера – 61; F – 1,53; ОS Ро – 18,2; С – 0,26; КБ – 56; F – 1,19.

Рисунок 7. Ребенок К. (состояние через 6 месяцев после козырьковой вискосинусотрабекулотомии обоих глаз): острота зрения OS повысилась до 0,13. ВГД на ОS снизилось до 18 мм рт. ст. Отек роговицы полностью купировался. Диаметр роговицы OS уменьшился до 13,5 мм. ПЗО уменьшилась до 22,7 мм. Глубина передней камеры стабилизировалась до 3,5 мм
При проведении гониоскопии левого глаза – сверху в зоне оперативного вмешательства визуализировалась сформированная фильтрационная щель. ПЗО OS по сравнению с исходными данными уменьшилась до 22,7 мм. Глубина передней камеры OS уменьшилась до 3,5 мм. При УЗ-сканировании отмечалось уменьшение глубины экскавации ДЗН на ОS до 1 мм.
Появилось форменное зрение на ОS = 0,13.
УБМ позволила изучить особенности акустической морфологии сформированных дренажных путей после антиглаукоматозной операции – в зоне фильтрационной подушечки выявлено наличие достаточного пространства для оттока внутриглазной жидкости (рисунок 8).
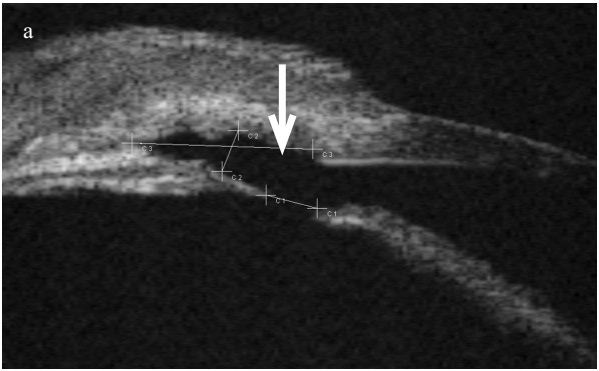
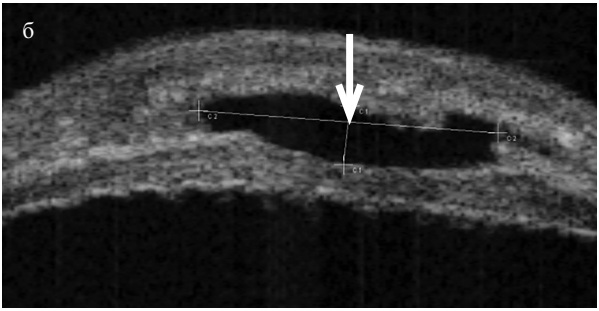
Рисунок 8. УБМ левого глаза ребенка К. с далекозашедшей ВГ, оперированной по разработанной методике козырьковой вискосинусотрабекулотомии через 3 месяца после операции. Визуализируются зоны акустически негативного интрасклерального пространства (а, б), заполненного внутриглазной жидкостью и сообщающегося с передней камерой (а), видна зона базальной иридэктомии
Ребенок наблюдался регулярно через 9, 12, 24 и 36 месяцев.
Через 36 месяцев (рисунок 9) гипотензивный эффект оставался стабильным (ВГД ОД = 16 мм рт. ст.; OS = 18 мм рт. ст.); по данным тонографии: ОD Ро – 14,7; С – 0,22; КБ – 79; F – 1,61; OS Ро – 16,6; С – 0,26; КБ – 61; F – 1,53; ПЗО ОD = 18,7; OS = 22,3 мм; фильтрационная подушечка была плоской, выраженной, функционировала; отмечалось уменьшение глубины экскавации ДЗН на ОS до 0,6 мм. Острота зрения на ОS повысилась до 0,4.
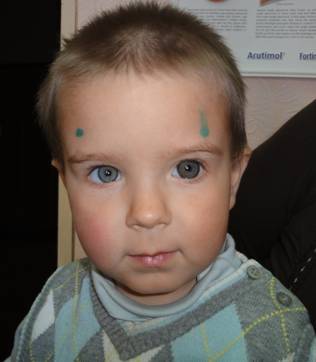
Рисунок 9. Ребенок К. (через 36 месяцев после козырьковой вискосинусотрабекулотомии обоих глаз): острота зрения повысилась до 0,4 на OS. ВГД оставалось стабильным: ОD = 16 мм рт. ст., OS = 18 мм рт. ст. Отек роговицы полностью купировался. ПЗО стабилизировалась до 22,3 мм
Оперативное лечение по разработанному оригинальному способу позволило получить снижение ВГД и сформировать дополнительные пути оттока внутриглазной жидкости c образованием в раннем послеоперационном периоде разлитой фильтрационной подушечки и сохранить ее в отдаленные сроки наблюдения, что подтверждалось, по данным УБМ, наличием интрасклерального пространства, заполненного внутриглазной жидкостью и сообщающегося с передней камерой, а также сохранившейся фильтрационной щели в зоне оперативного вмешательства при проведении гониоскопии.
Обсуждение
Рубцевание происходит в результате процессов адгезии раневых поверхностей, развития асептического воспаления и заместительной регенерации в области произведенного хирургического вмешательства. Учитывая особенности детского организма, заместительная регенерация тканей в детском возрасте идет значительно быстрее, следовательно, одним из путей решения данной проблемы, является поиск различных методик и материалов, использование которых позволит снизить интенсивность процессов рубцевания в зоне оперативного вмешательства [2, 4, 5, 9, 20, 41, 46, 53].
Известно, что использование различных дренажных устройств, а также антипролиферативных средств (5-ФУ, митомицин С, β-излучение) с целью борьбы с избыточным рубцеванием в детском возрасте, являются не безопасными для детского организма и сопряжены с риском развития тяжелых осложнений, таких как эндофтальмит, даже в отдаленном периоде наблюдений [13–15, 24, 26, 27, 31, 36, 41, 46, 53].
Одной из стремительно развивающихся областей офтальмологии является вискохирургия. Вискоэластичные полимеры все шире начинают использоваться в офтальмохирургии с различными целевыми назначениями. В настоящее время вископротекторы широко применяются при проведении операций по поводу катаракты для защиты тканей глаза, роговицы, радужки от механических повреждений; создания объемных пространств, необходимых для свободного манипулирования в камерах глаза в ходе хирургического вмешательства [2, 10, 12, 17, 20, 29, 37, 42].
Индивидуальные свойства вискоэластиков во многом определяются длиной цепи макромолекулы полимерной основы препарата. В зависимости от этой характеристики выделяют вискоэластики: с длинными цепями молекул – когезивные, обладающие высокой когезией (межмолекулярным сцеплением) и с относительно малой длиной макромолекулы – дисперсные или адгезивные (обладают низкой когезией) – они более текучи, прочнее соединяются с клетками тканей глаза, образуя на поверхности клеточного пласта плотную стабильную пленку [2, 17, 29, 32, 37, 48].
Учитывая свойства вискоэластиков, их стали применять не только в хирургии катаракты, но и глаукомы. Так, введение вискоэластика в шлеммов канал послужило для создания операции вискоканалостомии [47]. При хирургии псевдоэксфолиативной и открытоугольной глаукомы далекозашедших стадий вискоэластики различной плотности используют для предотвращения операционных осложнений [9, 17]. При хирургическом лечении неоваскулярной глаукомы вискоэластик расширяет супрахориоидальное пространство при выполнении вискоциклоиридоретракции [20].
Есть ряд сообщений о противовоспалительных свойствах гиалуроновой кислоты, входящей в состав вискоэластиков.
Так, абдоминальные хирурги используют пленки с гиалуроновой кислотой при операциях на органах брюшной полости и малого таза для предотвращения развития спаечного (рубцового) процесса [34, 43].
При лечении остеоартроза внутрисуставная инъекционная терапия препаратами гиалуроновой кислоты входит в список рекомендуемых мероприятий, оказывающих противовоспалительный эффект [19, 38, 44, 52].
Для повышения эффективности хирургического лечения косоглазия, офтальмохирурги помещали пленки с гиалуроновой кислотой между склерой, конъюнктивой и мышцами глазного яблока для профилактики сращений между ними [49, 50].
Forteza R. и соавт. (1999) из Университета в Майами провели исследование в сфере пульмонологии, где выявили, что гиалуроновая кислота подавляет выработку трахеобронхиальными железами воспалительного медиатора калликреина, влияющего на воспалительные и аллергические процессы в бронхах [35].
Гастроэнтерологи в эксперименте выявили, что гиалуроновая кислота предотвращает Т-клеточное поражение печени за счет снижения количества провоспалительных цитокинов у мышей [42].
В настоящее время установлено, что в присутствии гиалуроновой кислоты каскад воспалительной реакции блокируется, миграция лейкоцитов резко замедляется, количество воспалительных медиаторов в очаге повреждения уменьшается, а воспаление, как известно, является одним из ведущих факторов, способствующих развитию процессов рубцевания [32].
Результаты наших экспериментальных исследований показали, что поддержание объема созданного фильтрационного хода, в сочетании с противовоспалительными свойствами вискоэластика, содержащего гиалуроновую кислоту, тормозит процессы регенерации, предотвращая вновь созданные пути оттока от склеивания раневых поверхностей между собой и заполнения их просвета рубцовой тканью [6–9].
Исходя из изложенного следует, что противовоспалительные свойства гиалуроновой кислоты в составе вискоэластика могут быть использованы с целью подавления воспалительной реакции в зоне оперативного вмешательства.
Физико-химические свойства вискоэластика на основе гиалуроновой кислоты позволили нам использовать его для создания эффекта временного «жидкого» имплантата, заполняющего пространство между склеральными лоскутами и конъюнктивой, который механически предотвращает адгезию склеральных лоскутов и конъюнктивы между собой, а также снижает интенсивность асептического воспаления вследствие заместительной регенерации в области произведенного хирургического вмешательства.
Заключение
Разработанный способ хирургического лечения врожденной глаукомы – вискосинусотрабекулотомия – отличающийся введением дисперсионного вискоэластика с высоким содержанием гиалуроновой кислоты в переднюю камеру, между слоями склеры, склерой и конъюнктивой в зоне вмешательства, позволяет сохранить сформированные пути оттока внутриглазной жидкости как за счет временной их интубации «жидким» имплантатом – дисперсионным вискоэластиком, так и снижения интенсивности воспалительной реакции травмированных тканей под влиянием гиалуроновой кислоты в его составе, что в целом позволяет замедлить пролиферативную фазу развития грубой рубцовой соединительной ткани.
Разработанный способ козырьковой вискосинусотрабекулотомии с использованием дисперсионного вискоэластика на основе гиалуроновой кислоты является высокоэффективным методом фильтрационной хирургии врожденной глаукомы у детей, позволяющим добиться стойкой компенсации ВГД в раннем послеоперационном периоде в 98,9 % и сохранить гипотензивный эффект в отдаленные сроки наблюдения – через 12 месяцев в 94,4 %, через 24 месяца – в 94 % и спустя 36 месяцев – в 90 % случаев.
Достигнутый вследствие вискосинусотрабекулотомии стойкий и длительный гипотензивный эффект у детей на глазах с развитой и далекозашедшей стадиями врожденной глаукомы останавливает процессы растяжения оболочек глаза и стабилизирует их размеры: величину переднезадней оси, глубину передней камеры, диаметр роговицы, а также динамически уменьшает глубину экскавации диска зрительного нерва, что в целом позволяет сохранить и улучшить зрительные функции, а в младенческом возрасте – создать условия для их формирования.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
REFERENCES
- Аветисов СЭ, Кащенко ТП, Шамшинова АМ. Зрительные функции и их коррекция у детей. Москва: Медицина; 2005. Avetisov SE, Kashchenko TP, Shamshinova AM. [Visual Functions and Their Correction in Children]. Moscow; 2005. Russian.
- Азнабаев БМ, Семесько СГ, Кидралеева СР. Применение вископротекторов в офтальмологии: метод. рек. Уфа; 2000. Aznabaev BM, Semesko SG, Kidraleeva SR. [The use of viscoprotectors in ophthalmology]. Ufa; 2000. Russian.
- Алексеев БН. О некоторых причинах неудач при антиглаукоматозных операциях. Вестник офтальмологии. 1983;4:18-23. Alekseev BN. [Some causes of failures in antiglaucomatous operations]. 1983;4:18-23. Russian.
- Бессмертный АМ. Факторы риска избыточного рубцевания у больных первичной открытоугольной глаукомой. Глаукома. 2005;3:34-6. Bessmertnyy AM. [Risk factors for excessive scarring in patients with primary open-angle glaucoma]. Glaucoma. 2005;3:34-6. Russian.
- Боброва НФ, Трофимова НБ, Вит ВВ, Сорочинская ТА, Думброва НЕ, Молчанюк НИ. Вискохирургия врождённой глаукомы. V Российский общенациональный офтальмологический форум: материалы научн.-практ. конф. офт. с международным участием; 3-5 октября 2012; Москва, Россия. Bobrova NF, Trofmova NB, Vit VV, Sorochinskaya TA, Dumbrova NYe, Molchanyuk NI. [Viscosurgery of congenital glaucoma]. AROF 2012: Proceedings of the 5th Russian National Ophthalmologic Forum; 2012 Oct 3-5; Moscow, Russia.
- Боброва НФ, Вит ВВ, Думброва НЕ, Молчанюк НИ, Сорочинская ТА, Трофимова НБ. Данные световой и электронной микроскопии о влиянии вискоэластика содержащего соединения гиалуроновой кислоты на заместительную регенерацию путей оттока внутриглазной жидкости после операции синусотрабекулотомии (экспериментальное исследование). Сборник научных трудов Российской глаукомной школы «Глаукома: теория и практика». 2012;7:51-6.
- Боброва НФ, Вит ВВ, Думброва НЕ, Молчанюк НИ, Сорочинская ТА, Трофимова НБ. Заместительная регенерация путей оттока при использовании вискоэластика в хирургии глаукомы (экспериментальное исследование). Медицина XXI століття: матеріали науково-практич. конф. молод. вчених, присвяч. 150-річ. заснування Харківськго медичного товариства; 30 лист. 2011; Харків, Україна. Харків; 2011. C. 10-11.
- Боброва НФ, Вит ВВ, Думброва НЕ, Молчанюк НИ, Сорочинская ТА, Трофимова НБ. Особенности заместительной регенерации путей оттока при синусотрабекулотомии с использованием вискоэластика по данным световой и электронной микроскопии. Офтальмол. журн. 2011;6:28-34. Bobrova NF, Vit VV, Dumbrova NE, Molchanyuk NI, Sorochinskaya TA, Trofmova NB. [Peculiarities of Reparation of the Outflow Tracts in Sinusotrabeculotomy with the Application of Viscoelastic According to the Data of Light and Electron Microscopy]. Journal of Ophthalmology (Ukraine). 2011;6:28-34. Russian.
- Боброва НФ, Трофимова НБ, Вит ВВ, Думброва НЕ, Сорочинская ТА, Молчанюк НИ. Фильтрационная хирургия врождённой глаукомы у детей – вискосинустрабекулотомия. Офтальмохирургия. 2013;(2):62-67. Bobrova NF, Trofmova NB, Vit VV, Dumbrova NE, Sorochinskaya TA, Molchanyuk NI. [Filtration Surgery of Congenital Glaucoma in Children – Visсosinusotrabeculotomy]. Fyodorov Journal of Ophthalmic Surgery. 2013;(2):62-67. Russian.
- Ботабекова ТБ, Алдашева НА, Тлеубаева ГБ. Хирургическое лечение псевдоэксфолиативной глаукомы. Актуальные вопросы диагностики и лечения глаукомы и сосудистой патологии органа зрения: материалы международной конференции; 2005; Алматы, Казахстан.
- Васильева СФ, Суходоева ЛА, Чумак НН. Эффективность патогенетически обоснованных микрохирургических антиглаукоматозных операций у детей. Международная конференция офтальмологов городов-побратимов Одессы: материалы конференции; 1981; Одесса, Украина. С. 183-4.
- Волков ВГ, Строителев ВВ, Федорищев ИА. Гиалуроновая кислота и основные направления ее применения в медицине. Вестн. нов. мед. технол. 2001;8(1):67-71. Volkov VG, Stroitelev VV, Fedorishchev IA. [Gualuronic Acid and Main Trends of its Application in Medicine]. Journal of New Medical Technologies. 2001;8(1):67-71. Russian.
- Зелянина ЕВ. Применение митомицина С в хирургии рефрактерной глаукомы [диссертация]. Москва; 2004.
- Зубарева ЛН, Овчинникова АВ, Зелянина ЕВ. Первый опыт клинического применения митомицина-С в хирургии глаукомы у детей. Офтальмохирургия. 2000;2:9-15. Zubareva LN. [The frst experience of clinical application of mitomycin-C in glaucoma surgery in children]. Fyodorov Journal of Ophthalmic Surgery. 2000;2:9-15. Russian.
- Зубарева ЛН, Семикова ТС, Овчинникова АВ и др. Первый опыт применения беталучевой терапии в отдаленные сроки после антиглаукоматозных операций у детей. Перспективные направления в хирургическом лечении глаукомы: сборник научных трудов. Москва; 1997. C. 40-2.
- 3убарева ЛН, Овчинникова AB, Белоусова СН, Перекатова ЮК, Узунян ДГ. Ультразвуковая биомикроскопия в определении характера репаративного процесса в раннем послеоперационном периоде антиглаукоматозных операций фильтрующего типа у детей. Пролиферативный синдром в офтальмологии: материалы IV Международной научнопрактической конференции; 29-30 ноября 2006; Москва, Россия. Москва; 2006. С. 78-81.
- Клюев ГО, Панчешенко ИА, Кушнир ВЛ. Применение вискоэластиков в хирургии глаукомы с целью профилактики интра- и послеоперационных осложнений. Актуальные вопросы диагностики и лечения глаукомы и сосудистой патологии органа зрения: материалы международной конференции. Алматы; 2005.
- Краснов ММ, Мирзаянц МГ, Сидоров ЭГ. Клинико-морфологическое обоснование современной патогенетически ориентированной хирургии простого гидрофтальма. Офтальм. журн. 1990;3:148-53.
- Оганесян ОВ, Семенова ЛА, Хапилин АП, Косов ИС, Салтыкова ВГ. Применение препаратов гиалуроновой кислоты для лечения остеоартроза. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2007;2:41-6. Oganesyan OV, Semyonova LA, Khapilin AP, Kosov IS, Saltykova VG. [Use of Hyaluronic Acid for the Treatment of Osteoarthrosis]. Vestnik travmatologii i ortopedii im N.N. Priorova. 2007;2:41-6. Russian.
- Кузьміна де Гутарра ОВ, Недзвецька ОВ, автори; Харківська медична академія післядипломної освіти, власник. Спосіб хірургічного лікування неоваскулярної глаукоми. Патент України UA 18551. 15 листопада 2006.
- Боброва НФ, Сорочинська ТА, Кузьміна НБ, автори; ДУ «Інститут очних хвороб і тканинної терапії ім. В. П. Філатова НАМН України», власник. Спосіб козиркової віскосинусотрабекулотомії у хірургічному лікуванні вродженої глаукоми. Патент України UA 45099. 26 жовтня 2009.
- Сидоров ЭГ, Мирзаянц МГ. Врождённая глаукома и её лечение [монография]. Москва: Медицина; 1991.
- Сомов ЕЕ. Клиническая офтальмология [монография]. Москва: Медицина; 2005.
- Чеглаков ЮА, Кадымова ФЗ, Копаева СВ. Эффективность глубокой склерэктомии с применением дренажа из гидрогеля в отдаленном периоде наблюдения. Офтальмохирургия. 1990;2:28-31.
- Черкасов ИС. Дифференциальная диагностика врождённой глаукомы и эффективность её лечения [диссертация]. Одесса; 1968.
- Шмырёва ВФ, Мостовой ЕН. О применении цитостатической терапии 5-фторурацилом в хирургии глаукомы. Вестник офтальмологии. 2004;120(3):7-10. Shmyreva VF, Mostovoĭ EN. [The Use of Cytostat Therapy with 5-Fluorouracil in Surgery of Glaucoma]. Vestnik oftal’mologii. 2004;120(3):7-10. Russian.
- Agarwal HC, Sood NN, Sihota R, Sanga L, Honavar SG. Mitomycin-C in congenital glaucoma. Ophthalmic Surg Lasers. 1997 Dec;28(12):979-85.
- Allingham RR. Medical and surgical treatment for childhood glaucomas. In: Allingham RR, Damji KF, Freedman S, et al., editors. Shield’s textbook of glaucoma. 5th Ed. Philadelphia: Lippincott Williams and Wilkins; 2005. p. 623-43.
- Balazs EA. The introduction of elastoviscous hyaluronan for viscosurgery. In: Rosen ES, editor. Viscoelastic materials, Basic science and clinical applications. Pergamon Press; 1989. p. 149-65.
- Beauchamp GR, Parks MM. Filtering surgery in children: barriers to success. Ophthalmology. 1979 Jan;86(1):170-80. https://doi.org/10.1016/s0161-6420(79)35547-6
- Beck AD, Wilson WR, Lynch MG, Lynn MJ, Noe R. Trabeculectomy with adjunctive mitomycin C in pediatric glaucoma. Am J Ophthalmol. 1998 Nov;126(5):648-57. https://doi. org/10.1016/s0002-9394(98)00227-x
- Cooper CA, Brown KK, Meletis CD, Zabriskie N. Inflammation and Hyaluronic Acid. Alternative & complementary therapies. 2008 Apr;14(2):78-84. https://doi.org/10.1089/act. 2008.14201
- Elder MJ. Combined trabeculotomy-trabeculectomy compared with primary trabeculectomy for congenital glaucoma. Br. J. Ophthalmol. 1994 Oct;78(10):745-8. https://doi.org/10.1136/bjo.78.10.745
- Erkek AB, Remzi FH, Hammel JP, Akyuz M, Fazio VW. Effect of small bowel obstruction on functional outcome and quality of life in patients with ileal pouch-anal anastomosis: 10-year follow-up study. J Gastroenterol Hepatol. 2008 Jan;23(1):119-25. https://doi.org/10.1111/j.1440-1746.2006.04789.x
- Forteza R, Lauredo I, Abraham WM, Conner GE. Bronchial tissue kallikrein activity is regulated by hyaluronic acid binding. Am J Respir Cell Mol Biol. 1999 Dec;21(6):666-74. https://doi.org/10.1165/ajrcmb.21.6.3651
- Gilbert C, Foster A. Blindness in children: control priorities and research opportunities. Br J Ophthalmol. 2001 Sep;85(9):1025-7. https://doi.org/10.1136/bjo.85.9.1025
- Goa KL, Benfeld P. Hyaluronic acid. A review of its pharmacology and use as a surgical aid in ophthalmology, and its therapeutic potential in joint disease and wound healing. Drugs. 1994 Mar;47(3):536-66. https://doi.org/10.2165/00003495-199447030-00009
- Holmes MW, Bayliss MT, Muir H. Hyaluronic acid in human articular cartilage. Agerelated changes in content and size. Biochem J. 1988 Mar 1;250(2):435-41. https://doi.org/10.1042/bj2500435
- Kwitko ML. Glaucoma in infants and children. New York;1973. p. 45.
- Mandal AK, Matalia JH, Nutheti R, Krishnaiah S. Combined trabeculotomy and trabeculectomy in advanced primary developmental glaucoma with corneal diameter of 14 mm or more. Eye (Lond). 2006 Feb;20(2):135-43. https://doi.org/10.1038/sj.eye.6701817
- Miller MH, Rice NS. Trabeculectomy combined with beta irradiation for congenital glaucoma. Br J Ophthalmol. 1991 Oct;75(10):584-90. https://doi.org/10.1136/bjo.75.10.584
- Nakamura K, Yokohama S, Yoneda M, Okamoto S, Tamaki Y, Ito T, Okada M, Aso K, Makino I. High, but not low, molecular weight hyaluronan prevents T-cell-mediated liver injury by reducing proinflammatory cytokines in mice. J Gastroenterol. 2004;39(4):346-54. https://doi.org/10.1007/s00535-003-1301-x
- Playford RJ, Ghosh S. Cytokines and growth factor modulators in intestinal inflammation and repair. J Pathol. 2005 Mar;205(4):417-25. https://doi.org/10.1002/path.1722
- Saari H, Konttinen YT, Friman C, Sorsa T. Differential effects of reactive oxygen species on native synovial fluid and purified human umbilical cord hyaluronate. Inflammation. 1993 Aug;17(4):403-15. https://doi.org/10.1007/BF00916581
- Freedman SF, Johnston SC. Glaucoma in Infancy and Early Childhood. In: Wilson M, Trivedi R, Saunders R, editors. Pediatric Ophthalmology., Berlin, Heidelberg: Springer; 2009. р. 345-74. https://doi.org/10.1007/978-3-540-68632-3_24
- Sidoti PA, Belmonte SJ, Liebmann JM, Ritch R. Trabeculectomy with mitomycin-C in the treatment of pediatric glaucomas. Ophthalmology. 2000 Mar;107(3):422-9. https://doi.org/10.1016/s0161-6420(99)00130-x
- Stegmann R. Viscocanalostomy. Proceedings of the 18-th International Congress of Ophthalmology; 1998; Amsterdam, Netherlands. p. 94.
- Takahashi K, Goomer RS, Harwood F, Kubo T, Hirasawa Y, Amiel D. The effects of hyaluronan on matrix metalloproteinase-3 (MMP-3), interleukin-1beta(IL-1beta), and tissue inhibitor of metalloproteinase-1 (TIMP-1) gene expression during the development of osteoarthritis. Osteoarthritis Cartilage. 1999 Mar;7(2):182-90. https://doi.org/10.1053/joca.1998.0207
- Takeuchi K, Nakazawa M, Metoki T, Yamazaki H, Miyagawa Y, Ito T. Effects of solid hyaluronic acid film on postoperative fibrous scar formation after strabismus surgery in animals. J Pediatr Ophthalmol Strabismus. 2011 Sep-Oct;48(5):301-4. https://doi.org/10.3928/ 01913913-20100920-02
- Takeuchi K, Nakazawa M, Yamazaki H, Miyagawa Y, Ito T, Ishikawa F, Metoki T. Solid hyaluronic acid film and the prevention of postoperative fibrous scar formation in experimental animal eyes. Arch Ophthalmol. 2009 Apr;127(4):460-4. https://doi.org/10.1001/archophthalmol. 2009.70
- Thylefors B, Négrel AD. The global impact of glaucoma. Bull World Health Organ. 1994; 72(3):323-6.
- Yasui T, Akatsuka M, Tobetto K, Hayaishi M, Ando T. The effect of hyaluronan on interleukin-1 alpha-induced prostaglandin E2 production in human osteoarthritic synovial cells. Agents Actions. 1992 Sep;37(1-2):155-6. https://doi.org/10.1007/BF01987905
- Zalish M, Leiba H, Oliver M. Subconjunctival injection of 5-fluorouracil following trabeculectomy for congenital and infantile glaucoma. Ophthalmic Surg. 1992 Mar;23(3):203-5.
Стаття надійшла в редакцію 06.03.2020 р.
Рецензія на статтю надійшла в редакцію 19.03.2020 р.