- Автор: Super User
- Категорія: №1 (08) 2018
- Опубліковано: 31 серпня 2018
- Перегляди: 3536
УДК 617.735–018.82–02:616.379–008.64:617.715
https://doi.org/10.30702/Ophthalmology.2018/08.03
Бездітко П. А.1, Карлійчук М. А.2
1Харківський національний медичний університет, м. Харків, Україна
2Вищий державний навчальний заклад України «Буковинський державний медичний університет», м. Чернівці, Україна
Резюме. Робота присвячена вивченню особливостей змін комплексу гангліонарних клітин сітківки залежно від товщини решітчастої пластинки склери у 575 хворих (1150 очей) з цукровим діабетом. Першу групу – з незначним потовщенням решітчастої пластинки склери (< 700 мкм) – становили 78,6 % очей хворих із цукровим діабетом (904 ока); другу групу – із середнім потовщенням решітчастої пластинки склери (700–900 мкм) – 17,6 % очей хворих із цукровим діабетом (202 ока); третю групу – зі значним потовщенням решітчастої пластинки склери (> 900 мкм) – 3,8 % очей хворих із цукровим діабетом (44 ока). На основі аналізу обстеження 575 хворих із цукровим діабетом 2-го типу уточнено наукові дані про те, що томографічні особливості ураження зорового нерва залежать від товщини решітчастої пластинки склери: показник локального потоншення комплексу гангліонарних клітин сітківки (FLV) у хворих із середнім та значним потовщенням решітчастої пластинки склери у 13,2 та 16,4 раза відповідно перевищує аналогічні показники здорових осіб відповідного віку; показник загального потоншення комплексу гангліонарних клітин сітківки (GLV) у хворих із середнім та значним потовщенням решітчастої пластинки склери у 2,9 та 5,3 раза відповідно перевищує показник здорових осіб відповідного віку.
Ключові слова: комплекс гангліонарних клітин сітківки, цукровий діабет, решітчаста пластинка склери.
Розвиток ранньої нейроретинальної дегенерації при цукровому діабеті (ЦД) було встановлено в низці досліджень [2–6, 13]. Експериментально доведено, що при ЦД відзначається пошкодження ретроградного аксонального транспорту в гангліонарних клітинах сітківки, що призводить до пошкодження їх аксонів і клітинних тіл та проявляється потоншенням як гангліонарного шару, так і шару нервових волокон сітківки [2, 19, 22]. Клінічно за допомогою оптичної когерентної томографії (ОКТ) у хворих із ЦД було виявлено раннє потоншення шару нервових волокон, гангліонарного шару та інших шарів сітківки, що відбувалося ще до появи ознак діабетичної ретинопатії [5, 7, 11, 12, 13, 15].
Відомо, що структурні зміни решітчастої пластинки склери можуть призвести до деформації пор і безпосереднього ураження нервових волокон зорового нерва, які проходять крізь них [20]. Крім того, деформація решітчастої пластинки зумовлює пошкодження капілярів і порушення кровопостачання аксонів та, як наслідок, вторинне ураження зорового нерва [3, 8, 14, 17, 21]. Нещодавно Naim Terai зі співавторами виявили посилення жорсткості та зменшення еластичності решітчастої пластинки при стрептозидиновому діабеті у щурів [18]. У декількох дослідженнях було доведено, що зміна біомеханічних властивостей решітчастої пластинки (посилення ригідності) може відбуватися через крослінкінг колагену внаслідок відкладання АGE(advanced glycation end)-продуктів [9, 10, 16].
Таким чином, результатами експериментальних робіт ex vivo доведена зміна біомеханічних властивостей решітчастої пластинки при ЦД за рахунок посилення її жорсткості та зменшення еластичності. Зважаючи на тісний контакт решітчастої пластинки та аксонів гангліонарних клітин сітківки, логічно припустити існування взаємозв'язку між біомеханічними властивостями решітчастої пластинки склери у хворих із ЦД та змінами морфології макулярної зони сітківки.
МЕТА РОБОТИ
Визначити особливості змін комплексу гангліонарних клітин сітківки у хворих із ЦД залежно від товщини решітчастої пластинки склери.
МАТЕРІАЛИ ТА МЕТОДИ
Аналіз особливостей ураження зорового нерва здійснювали на основі даних обстеження 575 хворих (1150 очей) із ЦД 2-го типу. Була відібрана група хворих із ЦД 2-го типу з відсутньою глаукомою в анамнезі, в яких показники тонометричного тиску не перевищували 21 мм рт. ст. за Гольдманом. У дослідження включали лише еметропічні очі або очі з гіперметропією чи міопією слабкого ступеня; без катаракти або з початковою віковою катарактою; без хірургічних втручань (у тому числі лазерних) в анамнезі. Вік хворих коливався від 44 до 69 років, у середньому становив 55,9 ± 7,8 року. Тривалість ЦД до 5 років відзначалася в більшості хворих (71,8 %, 413 осіб), від 5 до 10 років – у 16,2 % хворих (93 особи), понад 10 років – у 12 % хворих (69 осіб).
Крім стандартних (візометрії, тонометрії, дослідження очного дна), методи офтальмологічного дослідження включали ОКТ сітківки та зорового нерва. Спектральну ОКТ здійснювали за допомогою RTVue-100 (Optovue, США) з роздільною здатністю 5 мікрон. Використовували новий спосіб вимірювання товщини решітчастої пластинки склери за допомогою SD-ОКТ із застосуванням програм LC_Thickness_programm.m та main_low_noise_flters_programm.m, заснований на алгоритмі адаптивної компенсації для усунення шуму високого рангу в глибоких шарах головки зорового нерва й покращення візуалізації задньої межі решітчастої пластинки, а також на обробці В-скану набором із 3-цифрових фільтрів: низькочастотним фільтром Батерворта інверсного зображення, низькочастотним фільтром аналізу вейвлет Добеши оригінального та інверсного зображення [1]. Площу склерального каналу решітчастої пластинки вимірювали за допомогою SD-ОКТ: з використанням програми LC_cut_position_programm.m для вибору глибини вимірювання та LC_diameter_calculation_programm.m для покращення обраного зображення основними цифровими фільтрами та визначення найбільш якісного для вимірювання [1]. Залежно від товщини решітчастої пластинки склери хворі були поділені на групи: перша група – з незначним потовщенням решітчастої пластинки склери (< 700 мкм) становила 78,6 % очей хворих із ЦД (904 ока); друга група – із середнім потовщенням решітчастої пластинки склери (700–900 мкм) – 17,6 % очей хворих із ЦД (202 ока); третя група – зі значним потовщенням решітчастої пластинки склери (> 900 мкм) – 3,8 % очей хворих із ЦД (44 ока).
Аналіз комплексу гангліонарних клітин сітківки проводили в макулярній ділянці діаметром 6 × 6 мм із центром 1 мм темпорально від ямочки (foveola), що відповідає 20º на мапі поля зору (10º у верхньому та нижньому напрямку, 7º у назальному та 13ºу темпоральному напрямку). Оцінювали такі показники: середню товщину комплексу гангліонарних клітин сітківки; Superior-inferior difference (S-I) – показник співвідношення товщини комплексу гангліонарних клітин сітківки у верхній та нижній половині; Focal loss volume (FLV; %) – показник локального потоншення комплексу гангліонарних клітин сітківки – інтегральний параметр відхилення на ділянці достовірної втрати комплексу гангліонарних клітин сітківки; Global loss volume (GLV; %) – показник загального потоншення комплексу гангліонарних клітин сітківки – сума всіх негативних показників відхилення на досліджуваній площі.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Аналізуючи показник середньої товщини комплексу гангліонарних клітин сітківки у хворих із ЦД, ми виявили його залежність від товщини решітчастої пластинки склери. Так, показник середньої товщини комплексу гангліонарних клітин сітківки у хворих із ЦД 1-ї групи з незначним потовщенням решітчастої пластинки склери коливався від 64,1 до 114,8 мкм, у середньому становив 92,1 ± 8,8 мкм, а 95 % довірчий інтервал сягав 87,5–97,1 мкм (таблиця 1). У 2-й групі хворих із ЦД із середнім потовщенням решітчастої пластинки склери цей показник коливався від 96,3 до 160,3 мкм, у середньому становив 114,0 ± 12,3 мкм з 95 % довірчим інтервалом 98,1–110,4 мкм. У хворих із ЦД 3-ї групи показник середньої товщини комплексу гангліонарних клітин сітківки коливався від 61,7 до 101,7 мкм, у середньому становив 84,9 ± 10,1 мкм, а 95 % довірчий інтервал – 79,3–90,1 мкм. Таким чином, середній показник середньої товщини комплексу гангліонарних клітин сітківки у хворих 2-ї групи на 19 % перевищував, а у хворих 3-ї групи – на 11,4 % був менше відповідного в контрольній групі (95,8 ± 8,2 мкм) (р < 0,05). Найменший середній показник середньої товщини комплексу гангліонарних клітин сітківки відзначили у хворих 3-ї групи, він на 34,3 % був нижче відповідного у хворих 2-ї групи (р < 0,001).

Аналізуючи показник товщини комплексу гангліонарних клітин верхньої половини сітківки у хворих із ЦД, ми виявили його залежність від товщини решітчастої пластинки склери. Так, вищезазначений показник у хворих із ЦД 1-ї групи з незначним потовщенням решітчастої пластинки склери коливався від 62,4 до 114,2 мкм, у середньому становив 91,2 ± 8,6 мкм, а 95 % довірчий інтервал сягав 87,0–95,6 мкм (таблиця 1). У 2-й групі хворих – коливався від 95,1 до 160,8 мкм, у середньому становив 116,3 ± 12,2 мкм з 95 % довірчим інтервалом 102,6– 119,2 мкм. У хворих із ЦД 3-ї групи показник товщини комплексу гангліонарних клітин верхньої половини сітківки коливався від 59,8 до 103,9 мкм, у середньому становив 82,5 ± 10,3 мкм, а 95 % довірчий інтервал – 76,6–88,5 мкм. Таким чином, середній показник товщини комплексу гангліонарних клітин верхньої половини сітківки у хворих 2-ї групи на 22 % перевищував, а у хворих 3-ї групи – на 13,4 % був менше відповідного в контрольній групі (95,3 ± 7,9 мкм) (р < 0,05). У хворих 1-ї групи цей показник достовірно не відрізнявся від такого в контрольній групі (р > 0,05). Найменшим (на 41 % нижче відповідного у хворих 2-ї групи) зазначений показник був у 3-й групі (р < 0,001).
Аналізуючи показник товщини комплексу гангліонарних клітин нижньої половини сітківки у хворих із ЦД, ми виявили його залежність від товщини решітчастої пластинки склери. Так, показник товщини комплексу гангліонарних клітин нижньої половини сітківки у хворих із ЦД 1-ї групи коливався від 65,7 до 115,3 мкм, у середньому становив 93,0 ± 9,0 мкм, а 95 % довірчий інтервал – 87,6–98,2 мкм (таблиця 1). У 2-й групі хворих із ЦД цей показник коливався від 94,3 до 160,9 мкм, у середньому становив 111,7 ± 12,4 мкм з 95 % довірчим інтервалом 105,2–117,8 мкм. У хворих із ЦД 3-ї групи показник товщини комплексу гангліонарних клітин верхньої половини сітківки коливався від 62,9 до 99,9 мкм, у середньому становив 87,3 ± 9,9 мкм, а 95 % довірчий інтервал – 81,8–83,4 мкм. Таким чином, середній показник товщини комплексу гангліонарних клітин нижньої половини сітківки у хворих 2-ї групи на 16,1 % перевищував, а у хворих 3-ї групи – на 9,3 % був менше відповідного в контрольній групі (96,2 ± 8,4 мкм) (р < 0,05). У хворих 1-ї групи досліджуваний показник достовірно не відрізнявся від такого в контрольній групі (р > 0,05). Найменшим (на 27,9 % нижче відповідного у хворих 2-ї групи) цей показник був у хворих 3-ї групи (р < 0,001).
Аналізуючи показник співвідношення товщини комплексу гангліонарних клітин сітківки у верхній та нижній половині (S-I) у хворих із ЦД, ми виявили залежність її від товщини решітчастої пластинки склери. Так, показник співвідношення товщини комплексу гангліонарних клітин сітківки у верхній та нижній половині (S-I) у хворих із ЦД 1-ї групи з незначним потовщенням решітчастої пластинки склери коливався від –11,3–6,1, у середньому становив –1,8 ± 3,3, а 95 % довірчий інтервал становив –5,6–2,2 (таблиця 1). У 2-й групі хворих із ЦД із середнім потовщенням решітчастої пластинки склери цей показник коливався від –16,9–20,7, у середньому становив 4,6 ± 8,3 з 95 % довірчим інтервалом 0,6–10,8. У хворих із ЦД 3-ї групи показник співвідношення товщини комплексу гангліонарних клітин сітківки у верхній та нижній половині (S-I) коливався від –5,8–15,5, у середньому становив –4,8 ± 5,0, а 95 % довірчий інтервал сягав –7,5–(–1,4). Таким чином, середній показник співвідношення товщини комплексу гангліонарних клітин сітківки у верхній та нижній половині (S-I) у хворих 2-ї групи у 5,5 раза перевищував, а у хворих 3-ї групи – у 5,3 раза був менше відповідного в контрольній групі (–0,9 ± 2,2) (р < 0,05).
Аналізуючи показник загального потоншення комплексу гангліонарних клітин сітківки (GLV) у хворих із ЦД, ми також виявили його залежність від товщини решітчастої пластинки склери. Так, у хворих із ЦД 1-ї групи він коливався від 0,04 до 11,53 %, у середньому становив 5,02 ± 3,65 %, а 95 % довірчий інтервал – 2,53– 7,61 % (таблиця 2). У хворих 2-ї групи із середнім потовщенням решітчастої пластинки склери цей показник коливався від 3,23 до 32,79 %, у середньому становив 10,34 ± 6,87 % з 95 % довірчим інтервалом 5,09–15,51 %. У хворих із ЦД 3-ї групи зі значним потовщенням решітчастої пластинки склери показник GLV коливався від 9,03 до 31,17 %, у середньому становив 18,55 ± 5,91 %, а 95 % довірчий інтервал – 14,42–22,39 %. Таким чином, середній показник загального потоншення комплексу гангліонарних клітин сітківки (GLV) у хворих 2-ї групи у 2,9 раза, а 3-ї групи – у 5,3 раза перевищував відповідний у контрольній групі (3,51 ± 2,73 %) (р < 0,001). Найвищим цей показник був у хворих 3-ї групи, де він у 1,8 раза перевищував відповідний показник у 2-й групі та у 3,7 раза у 1-й групі (р < 0,001).
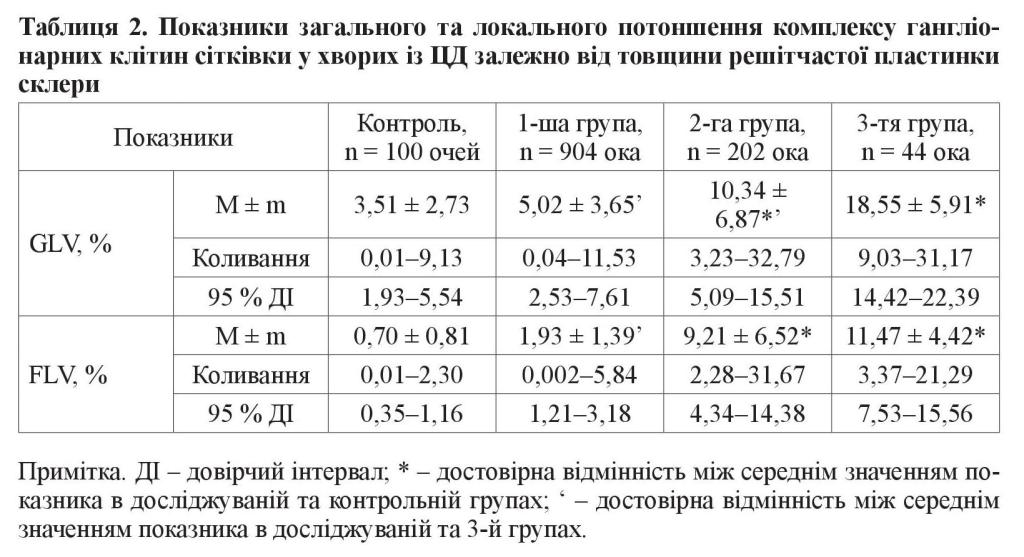
Показник локального потоншення комплексу гангліонарних клітин сітківки (FLV) у хворих із ЦД 1-ї групи з незначним потовщенням решітчастої пластинки склери коливався від 0,002 до 5,84 %, у середньому становив 1,93 ± 1,39 %, а 95 % довірчий інтервал – 1,21–3,18 % (таблиця 2). У хворих із ЦД 2-ї групи цей показник коливався від 2,28 до 31,67 %, у середньому становив 9,21 ± 6,52 % з 95 % довірчим інтервалом 4,34–14,38 %. У хворих із ЦД 3-ї групи показник FLV коливався від 3,37 до 21,29 %, у середньому становив 11,47 ± 4,42 %, а 95 % довірчий інтервал – 7,53–15,56 %. Таким чином, середній показник локального потоншення комплексу гангліонарних клітин сітківки (FLV) у хворих 2-ї групи у 13,2 раза, а 3-ї групи – у 16,4 раза перевищував відповідний показник у контрольній групі (0,70 ± 0,81 %) (р < 0,001). Вищезазначений показник у хворих 1-ї групи достовірно не відрізнявся від такого в контрольній групі (р > 0,05). Найвищим цей показник був у хворих 3-ї групи, де він у 5,9 раза перевищував відповідний у 1-й групі (р < 0,001), але достовірно не відрізнявся від показника 2-ї групи (р > 0,05).
ВИСНОВКИ
Уточнено наукові дані про те, що томографічні особливості ураження зорового нерва залежать від товщини решітчастої пластинки у хворих із ЦД: показник локального потоншення (FLV) комплексу гангліонарних клітин сітківки у хворих із середнім і значним потовщенням решітчастої пластинки склери у 13,2 та 16,4 раза відповідно перевищує аналогічні показники здорових осіб відповідного віку; показник загального потоншення (GLV) комплексу гангліонарних клітин сітківки у хворих із середнім і значним потовщенням решітчастої пластинки склери у 2,9 та 5,3 раза відповідно перевищує показник здорових осіб відповідного віку.
Бездетко П. А.1, Карлийчук М. А.2
1Харьковский национальный медицинский университет, г. Харьков, Украина
2Высшее учебное учреждение Украины «Буковинский государственный медицинский университет», г. Черновцы, Украина
Особенности изменений комплекса ганглионарных клеток сетчатки у больных с сахарным диабетом в зависимости от толщины решетчатой пластинки склеры
Резюме. Работа посвящена изучению особенностей изменений комплекса ганглионарных клеток сетчатки в зависимости от толщины решетчатой пластинки склеры у 575 больных (1150 глаз) с сахарным диабетом. Первую группу с незначительным утолщением решетчатой пластинки склеры (< 700 мкм) – составили 78,6 % глаз больных с сахарным диабетом (904 глаза); 2-ю группу – со средним утолщением решетчатой пластинки склеры (700–900 мкм) – составили 17,6 % глаз больных с сахарным диабетом (202 глаза); 3-ю группу – со значительным утолщением решетчатой пластинки склеры (> 900 мкм) – составили 3,8 % глаз больных с сахарным диабетом (44 глаза). На основе анализа обследования 575 больных с сахарным диабетом 2-го типа уточнены научные данные о том, что томографические особенности поражения зрительного нерва зависят от толщины решетчатой пластинки склеры: показатель локального истончения комплекса ганглионарных клеток сетчатки (FLV) у больных со средним и значительным утолщением решетчатой пластинки склеры в 13,2 и 16,4 раза соответственно превышает аналогичные показатели здоровых лиц соотвествующего возраста; показатель общего истончения комплекса ганглионарных клеток сетчатки (GLV) у больных со средним и значительным утолщением решетчатой пластинки склеры в 2,9 и 5,3 раза соответственно превышает показатель здоровых лиц соотвествующего возраста.
Ключевые слова: комплекс ганглионарных клеток сетчатки, сахарный диабет, решетчатая пластинка склеры.
Bezditko P. A.1, Karliychuk M. A.2
1Kharkiv National Medical University, Kharkiv, Ukraine
2Higher State Educational Establishment of Ukraine “Bukovinian State Medical University”, Chernivtsi, Ukraine
Peculiarities of the retinal ganglion cell complex changes in patients with diabetes mellitus depending on the scleral lamina cribrosa thickness
Abstract. According to the several experimental studies, the biomechanical properties of optic nerve head change in diabetes mellitus (DM) that might be explained by nonenzymatic collagen cross-linking mediated by advanced glycation end products due to high glucose levels in diabetes. Lamina cribrosa morphology is ever changing in health and disease, and its changes might cause primary optic nerve damage and secondary damage due to blood supply decreasing and axoplasmic flow blockade within retinal ganglion cell axons. So, morphological changes of the lamina cribrosa may be a precondition of the optic nerve and retinal ganglion cells damage in DM.
The aim was to define the peculiarities of the ganglion retinal cells complex in patients with diabetes mellitus depending on the scleral lamina cribrosa thickness.
Material and methods of research. 575 patients with type II diabetes were examined. In addition to standard ophthalmologic methods included optical coherent tomography of the retina and optic nerve. In the 1st group (78.9 % of eyes of the patients with DM) a scleral lamina cribrosa mild thickening (< 700 μm) was observed; in 16.6 % of eyes (the 2nd group) a moderate thickening (700–900 μm), and in 3.8 % of eyes (the 3rd group) a significant thickening (< 900 μm) was observed.
Results. Analyzing the index of an average ganglion retinal cell complex in diabetic patients, its dependence on scleral lamina cribrosa thickness was revealed. The average index of ganglion retinal cells global loss volume (GLV) in the 2nd group was 2.9 times higher, in the 3rd group – 5.3 times higher than that in the control group (3.51 ± 2.73 %) (р < 0.001). The focal loss volume (FLV) index of the retinal ganglion cell complex in patients with moderate and significant thickening of the scleral lamina cribrosa was 13.2 and 16.4 times respectively higher than that in healthy individuals (р < 0.001). The highest index of FLV of the retinal ganglion cell complex was observed in the patients of the 3rd group that was 5.9 times higher than that of the 1st group (р < 0.001).
Conclusions. The scientific data about the dependence of the tomographic peculiarities of the optic nerve damage on the scleral lamina cribrosa thickness in diabetic patients were amplified. The focal loss volume index of the retinal ganglion cell complex in patients with moderate and significant thickening of the scleral lamina cribrosa was 13.2 and 16.4 times respectively higher than the corresponding indices in healthy individuals. The index of ganglion retinal cells global loss volume in the patients with scleral lamina cribrosa moderate thickening was 2.9 times higher, in patients with scleral lamina cribrosa significant thickening – 5.3 times higher than that in the healthy individuals.
Keywords: retinal ganglion cell complex, diabetes mellitus, scleral lamina cribrosa.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
REFERENCES
- Особливості використання спектральної оптичної когерентної томографії для дослідження товщини решітчастої пластини склери та площі її склерального каналу / П. А. Бездітко, М. А. Карлійчук, О. О. Луханін, О. В. Заволока // Харківська хірургічна школа. – 2017. – № 3–4 (84–86). – С. 63–69. Bezditko PA, Karliychuk MA, Lukhanin OO, Zavoloka OO. [Peculiarities of spectral coherent tomography using for investigation of the scleral lamina cribrosa thickness and the area of its scleral channel]. Kharkivskakhirurhichnashkola. 2017;3–4(84–86):63–9. (in Ukrainian).
- Barber AJ. Diabetic retinopathy: recent advances towards understanding neurodegeneration and vision loss. Sci China Life Sci. 2015;58(6):541–9.
- Burgoyne CF. A biomechanical paradigm for axonal insult within the optic nerve head in aging and glaucoma. Exp Eye Res. 2011;93(2):120–32.
- Carpineto P, Toto L, Aloia R, Ciciarelli V, Borrelli E, Vitacolonna E, Di Nicola M, Di Antonio L, Mastropasqua R. Neuroretinal alterations in the early stages of diabetic retinopathy in patients with type 2 diabetes mellitus. Eye (Lond). 2016;30(5):673–9. https://doi.org/10.1038/eye.2016.13
- El-Fayoumi D, Badr Eldine NM, Esmael AF, Ghalwash D, Soliman HM. Retinal Nerve Fiber Layer and Ganglion Cell Complex Thicknesses Are Reduced in Children With Type 1 Diabetes With No Evidence of Vascular Retinopathy. Invest Ophthalmol Vis Sci. 2016 Oct; 57(13):5355–60. https://doi.org/10.1167/iovs.16-19988
- Gundogan FC, Akay F, Uzun S, Yolcu U, Зağıltay E, Toyran S. Early Neurodegeneration of the Inner Retinal Layers in Type 1 Diabetes Mellitus. Ophthalmologica. 2016;235(3): 125–32. https://doi.org/10.1159/000442826
- Kern TS, Barber AJ. Retinal ganglion cells in diabetes. J Physiol. 2008 Sep;586(18): 4401–8.
- Kim JH, Lee TY, Lee JW, Lee KW. Comparison of the thickness of the lamina cribrosa and vascular factors in early normal-tension glaucoma with low and high intraocular pressures. Korean J Ophthalmol. 2014 Dec;28(6):473–8.
- Lapolla A, Fedele D, Reitano R, Bonfante L, Pastori G, Seraglia R, Tubaro M, Traldi P. Advanced glycation end products/peptides: an in vivo investigation. Ann N Y Acad Sci. 2005 Jun;1043:267–75.
- Mabuchi F, Lindsey JD, Aihara M, Mackey MR, Weinreb RN. Optic nerve damage in mice with a targeted type I collagen mutation. Invest Ophthalmol Vis Sci. 2004 Jun;45(6): 1841–5.
- Ng DS, Chiang PP, Tan G, Cheung CG, Cheng CY, Cheung CY, Wong TY, Lamoureux EL, Ikram MK. Retinal ganglion cell neuronal damage in diabetes and diabetic retinopathy. Clin Exp Ophthalmol. 2016 May;44(4):243–50. https://doi.org/10.1111/ceo.12724
- Pekel E, Tufaner G, Kaya H, Kaşıkçı A, Deda G, Pekel G. Assessment of optic disc and ganglion cell layer in diabetes mellitus type 2. Medicine (Baltimore). 2017 Jul;96(29): e7556.
- Rodrigues E, Urias MG, Penha FM, Badaró E, Novais E, Meirelles R, Farah ME. Diabetes induces changes in neuroretina before retinal vessels: a spectral-domain optical coherence tomography study. Int J Retina Vitreous. 2015 Apr;1:4. https://doi.org/10.1186/s40942-015- 0001-z
- Sigal IA, Ethier CR. Biomechanics of the optic nerve head. Exp Eye Res. 2009 Apr;88(4): 799–807.
- Simo R, Hernandez C; European Consortium for the Early Treatment of Diabetic Retinopathy (EUROCONDOR). Neurodegeneration in the diabetic eye: new insights and therapeutic perspectives. Trends Endocrinol Metab. 2014 Jan;25(1):23–33.
- Spoerl E, Boehm AG, Pillunat LE. The influence of various substances on the biomechanical behavior of lamina cribrosa and peripapillary sclera. Invest Ophthalmol Vis Sci. 2005 Apr;46(4):1286–90.
- Tatham AJ, Miki A, Weinreb RN, Zangwill LM, Medeiros FA. Defects of the lamina cribrosa in eyes with localized retinal nerve fiber layer loss. Ophthalmology. 2014 Jan;121(1): 110–8.
- Terai N, Spoerl E, Haustein M, Hornykewycz K, Haentzschel J, Pillunat LE. Diabetes mellitus affects biomechanical properties of the optic nerve head in the rat. Ophthalmic Res. 2012;47(4):189–94.
- van Dijk HW, Kok PH, Garvin M, Sonka M, DeVries JH, Michels RP, van Velthoven MEJ, Schlingemann RO, Verbraak FD, Abràmoff MD. Selective loss of inner retinal layer thickness in type 1 diabetic patients with minimal diabetic retinopathy. Invest Ophthalmol Vis Sci. 2009 Jul;50(7):3404–9. https://doi.org/10.1167/iovs.08-3143
- Voorhees AP, Jan NJ, Sigal IA. Effects of collagen microstructure and material properties on the deformation of the neural tissues of the lamina cribrosa. Acta Biomater. 2017 Aug; 58:278–90.
- Winkler M, Jester B, Nien-Shy C, Massei S, Minckler DS, Jester JV, Brown DJ. High resolution three dimensional reconstruction of the collagenous matrix of the human optic nerve head. Brain Res Bull. 2010;81(2–3):339–48. https://doi.org/10.1016/j.brainresbull.2009. 06.001
- Zhang L, Ino-ue M, Dong K, Yamamoto M. Retrograde axonal transport impairment of large- and medium-sized retinal ganglion cells in diabetic rat. Curr Eye Res. 2000 Feb; 20(2):131–6.
Стаття надійшла в редакцію 18.11.2017 р.
Рецензія на статтю надійшла в редакцію 20.12.2017 р.